
8. 在指定环境中,下列各组离子一定可以大量共存的是 ( )
A.使pH试纸呈红色的溶液:Fe2+、NO3-、SO42-、Na+
B.常温下,在c(H+)/c(OH-) = 1×1012的溶液:HCO3-、Mg2+、C1-、K+
C.加入铝粉放出氢气的溶液:Na+、Cl-、K+ SO42-
D.使无色酚酞试液显红色的溶液:S2-、K+、Na+、Al3+
7.设NA为阿伏加德罗常数值,下列叙述中不正确的是 ( )
A.12.4g白磷晶体中含有的P-P键数是0.6NA
B.2.9g 2CaSO4·H2O 含有的结晶水分子数为0.02 NA
C.100 g的98%的浓 H2SO4中所含的硫原子数为 NA
D.2molSO2和1molO2 混合在V2O5存在的条件下密闭容器中加热反应后,容器内物质分子数大于2 NA
25.环保检测中,有害气体的浓度常用1L气体样品中含有害气体的毫克值(mg/L)来表示,如对某气体样品中所含CO的浓度进行测定,其方法和步骤如下:
①首先将2.00L的气体样品通过盛有I2O5固体的加热管,反应后生成CO2和I2;
②用30.0mL 5.00×10-3mol·L-1的硫代硫酸钠溶液吸收所产生的碘,发生的反应为:
I2+2S2O2-3=2I-+S4O2-6;
③将②中溶液取出1/5,加入1.00mL 1.00×10-2mol·L-1碘水,正好将所取溶液中过量的硫代硫酸钠完全氧化。
(1)写出步骤①中CO通过盛I2O5加热管的有关反应化学方程式。
(2)计算样品中CO的浓度(mg/L)。
24.如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。试回答下列问题:
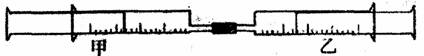
|
实验序号 |
甲针筒内物质 |
乙针筒内物质 |
甲针筒的现象 |
|
1 |
10mLFeSO4溶液 |
10mLNH3 |
生成白色沉淀,后变色 |
|
2 |
20mLH2S |
10mL SO2 |
|
|
3 |
30mLNO2(主要) |
10mL H2O(l) |
剩余无色气体,活塞自动向内压缩 |
|
4 |
15mL Cl2 |
30mL NH3 |
|
(1)实验1中,沉淀最终变为______色,写出沉淀变色的化学方程式__________。
(2)实验2甲针筒内的现象是:有___________生成,活塞________移动(填向外、向内、不)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入______溶液中。
(3)实验3中,甲中的30mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是__ __,写出NO2与H2O反应的化学方程式为_________________。
(4)实验4中,已知:3Cl2+2NH3 ==N2+6HCl。甲针筒出活塞有移动,针筒内有白烟产生外,气体的颜色变为__________。最后针筒内剩余气体的体积约为_______mL。
23.V、W、X、Y、Z是由周期表中1~20号部分元素组成的5种化合物,其中V、W、X、Z均由两种元素组成,上述5种化合物涉及的所有元素的原子序数之和等于35。它们之间的反应关系如下图:

(1)V的电子式是 、W的化学式是 、X的结构式是 、Y的俗名是 、Z的结构简式是 。
(2)由上述5种化合物中2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是 :
22.氮及其化合物在生活、生产和科技等方面有重要的应用。请回答下列问题:
(1)氮元素基态原子的价电子排布式为 。
(2)在氮气分子中,氮原子之间存在着 个σ键和 个π键;
(3)氮、氧、氟是周期表中相邻的三种元素,比较:(填“大于”、“小于”或“等于”)
①氮原子的第一电离能 (填“大于”、“小于”或“等于”)氧原子的第一电离能;
②N2分子中氮氮键的键长 (填“大于”、“小于”或“等于”)F2分子中氟氟键的键长;
(4)氮元素的氢化物(NH3)是一种易液化的气体,请阐述原因是 ;
(5)配合物[Cu(NH3)4]Cl2中含有4个配位键,若用2个N2H4代替其中的2个NH3,得到的配合物[Cu(NH3)2(N2H4)2]Cl2中含有配位键的个数为 。
21.某反应的反应物和产物如下:
KMnO4+ KI+ H2SO4→ MnSO4+ I2+ KIO3+ K2SO4+ H2O
(1)该反应的氧化剂是 ;
(2)如果该反应议程式中I2和KIO3的系数都是5,则:
①KMnO4的系数是 ;
②配平上面的化学方程式,将系数填在相关物质前方的空格处,并在方程式上标出电子转移的方向和数目。
20.写出下列反应的离子方程式:
(1)石灰水中加入少量Cs(HCO3)2溶液 ;
(2)苯酚钠溶液中通入少量CO2气体 ;
(3)向NaAlO2溶液中滴加过量的NaHCO3溶液 ;
(4)NaHSO4溶液与Ba(OH)2溶液反应至中性 。
19.把NH4HCO3、CuSO4、MgCl2、Al2(SO4)3固体混合物溶于水中,加入过量盐酸后,再加入过量氢氧化钠溶液,过滤,把滤液加热煮沸后,溶液中大量存在的阴离子是 。
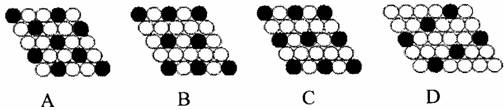
18.下面二维平面晶体所表示的化学式为AX3的是 ( )
第Ⅱ卷(非选择题,共58分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com