
19.(15分)合成氨工业的核心反应是:


 ;ΔH=
;ΔH=
能量变化如下图,回答下列问题:

(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 ,
E2 (填“增大”、“减小”、“不变”)
(2)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量 (填“<”、“>”或“=”)46.2kJ,理由是 __________________________________________________________;
(3)关于该反应的下列说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S< 0
C.△H<0,△S>0 D.△H<0,△S<0
(4)将一定量的N2(g)和H2(g)放入 1L密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.10mol,H2为0.30mol,NH3为0.10mol。计算该条件下达到平衡时H2转化为NH3的转化率 ,该温度下的平衡常数K值 。若升高温度,K值变化 (填“增大”、“减小”或“不变”)。
(5)在上述(4)反应条件的密闭容器中,欲提高合成氨中H2的转化率,下列措施可行的是 (填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.分离出氨
18.(10分)(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的
实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如下图所示。则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”)。设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2。
则m1 m2(选填“<”、“=”、“>”)

(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________ 沉淀(填化学式),生成该沉淀的离子方程式为
____________ 。(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。)
17.(13分)已知某无色溶液中只含有包括Na+、CH3COO-在内的四种离子,请回答下列问题:
(1)若该溶液中只含有一种溶质,则该溶液显 性。
相关的离子方程式为 。
(2)若该溶液呈酸性,则溶液中的溶质为 。
(3)若溶液中含有两种溶质,且溶液呈碱性,则该溶液中不可能出现的离子浓度大小关系是 。(选填编号字母)
A.c(Na+)>c(CH3COO-) B.c(CH3COO-)> c(Na+)
C.c(OH-)> c(Na+) D.c(Na+)> c(OH-)
E.c(OH-)>c(CH3COO-) F. c(CH3COO-)> c(OH-)
(4)在稀氨水中存在下述电离平衡NH3+H2O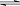 NH3·H2O
NH3·H2O NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?
|
加入的物质 |
少量(NH4)2SO4固体 |
少量HNO3溶液 |
少量KOH溶液 |
|
c(OH-)的变化 |
① |
② |
③ |
|
平衡移动方向 |
④ |
⑤ |
⑥ |
16. 已知:25℃时,K[Mg(OH)2]=5.61×10-12,K[MgF2]=7.43×10-11。下列说法正确的是
A.25℃时,饱和Mg(OH)2溶液与饱和MgH溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的K比在20 mL 0.01 mol·L-1 NH4Cl溶液中的K小
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
15. 下列说法正确的是
A.将AlCl3溶液、Na2SO3溶液蒸干并灼烧可分别得到Al2O3、Na2SO3
B.在溶液的稀释过程中,离子浓度有的可能增大,有的可能减小,有的可能不变
C. 0.1
mol/L CH3COOH溶液在稀释过程中 将变小
将变小
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
14.下列说法中,正确的是
A.0.1 mol·L-1的醋酸溶液加水稀释,c(H+)、c(OH-)同比例减小
B.体积相同、pH相同的醋酸溶液、盐酸,完全溶解少量且等量的锌粉,前者用时少
C.若常温下H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ·mol-1,
则H+(aq)+NH3·H2O(aq)=NH4+(aq)+H2O(l)ΔH=-57.3 kJ·mol-1
D.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)
13. 相同温度下,将足量的AgCl分别放入下列溶液中: ①40mL 0.02mol/L BaCl2溶液 ② 40mL 0.03mol/L 盐酸 ③10mL 蒸馏水 ④ 50mL0.05mol/L AgNO3溶液,则AgCl的溶解度大小顺序为
A. ③ > ② > ① > ④ B.④ > ② > ① > ③
C. ③ > ① > ② > ④ D. ① = ② = ③ = ④
12. 常温下,下列各组数据中比值为2:1的是
A.电解熔融氯化钠,在阴极和阳极上析出产物的物质的量之比
B.中和体积相同、pH相同的硫酸和盐酸消耗NaOH的物质的量之比
C.1 mol·L-1氨水溶液与0.5 mol·L-1氨水溶液中c(OH-)之比
D.物质的量相同的水和乙酸与足量金属钠反应产生氢气的体积之比
11.下列叙述中,错误的是
A.虽然固体氯化钠不能导电,但氯化钠是电解质
B.纯水的pH随温度的升高而减小
C.在醋酸钠溶液中加入少量氢氧化钠,溶液中c(OH-)增大
D.在纯水中加入少量硫酸铵,可抑制水的电离
10.下列说法错误的是
A.对于反应C(s)+ CO2 (g) =2CO(g),△H >0,升高温度会加快化学反应速率
B.合成氨反应中,当3v(NH3)正=2v(H2)逆时,反应达到平衡
C.将nmol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者
D.对于反应PCl5(g) PCl3(g)+Cl2(g),达到平衡后,若保持温度容积不变,又加入一定量的PCl5,则该平衡向正方向移动,但平衡时PCl5的转化率减小
PCl3(g)+Cl2(g),达到平衡后,若保持温度容积不变,又加入一定量的PCl5,则该平衡向正方向移动,但平衡时PCl5的转化率减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com