
22.(8分)现有S2-、NH4+、Al3+、Na+、SO42-、Fe3+、HCO3-、Cl-等离子,请按要求填空:
(1)在水溶液中,该离子水解呈碱性的是______________________________。
(2)在水溶液中,该离子水解呈酸性的是_____________________________。
(3)既能在酸性较强溶液里、又能在碱性较强的溶液里大量存在的离子有__________。
(4)既不能在酸性较强溶液里、又不能在碱性较强的溶液里大量存在的离子有_________。
21.(2分)同素异形体相互转化的反应热相当小而且转化速率很慢,有时还很不完全,测定反应热有时很困难,因此常用盖斯定律进行计算得到相应数据。已知:
P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1
P(红磷,s)+ O2(g)=
O2(g)=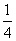 P4O10(s) △H=-738.5kJ·mol-1
P4O10(s) △H=-738.5kJ·mol-1
则白磷转化为红磷的热化学方程式为____________________。
20.25℃时,pH=5的NH4Cl溶液中,由水电离出的 浓度是 ( )
浓度是 ( )
A. B.
B.
C. D.
D.
第II卷(共计50分)
19.已知一种c(H+)=1×10-3mol/L的酸和一种c(OH-)=1×10-3mol/L的碱溶液等体积混合后溶液呈酸性,其原因可能是: ( )
A.浓的强酸和稀的强碱溶液反应 B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应 D.生成了一种强酸弱碱盐
18.在一定条件下,固定容积的密闭容器中反应:2NO2(g) O2(g)+2NO(g);DH>0,达到平衡。当改变其中一个条件X,Y随X的变化不符合图中曲线的是 ( )
O2(g)+2NO(g);DH>0,达到平衡。当改变其中一个条件X,Y随X的变化不符合图中曲线的是 ( )

A.当X表示温度时,Y表示NO2的物质的量
B.当X表示压强时,Y表示NO2的转化率
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量,Y表示O2的物质的量
17.在一个固定体积的密闭容器中,放入mmol的A和nmol的B,发生如下反应:
mA(g)+nB(g) pC(g),平衡时C的浓度是wmol·L-1,若维持容器的体积不变,起始时放入amolA、bmolB和c molC,要使平衡时C的浓度仍为wmol·L-1,则a、b、c必须满足的条件是 ( )
pC(g),平衡时C的浓度是wmol·L-1,若维持容器的体积不变,起始时放入amolA、bmolB和c molC,要使平衡时C的浓度仍为wmol·L-1,则a、b、c必须满足的条件是 ( )
A.a:b:c=m:n:p
B.a:b=m:n和
C. 和
和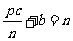 D.a=
D.a= , c=
, c= 和c=
和c=
16.相同容积的四个密闭容器中,进行同样的可逆反应: ( )
 2A(g)+B(g)===3C(g)+2D(g)
2A(g)+B(g)===3C(g)+2D(g)

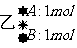


在相同温度下建立平衡时,A或B的转化率大小关系为
A.A的转化率为:甲<丙<乙<丁
B.A的转化率为:甲<乙<丙<丁
C.B的转化率为:丁>乙>丙>甲
D.B的转化率为:甲>丙>乙>丁
15.强酸和强碱在稀溶液中的中和热可表示为: ( )
H+(aq)+OH-(aq)=H2O(l);△H= -57.3k kJ·mol-1,又知在溶液中反应有:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l); △H=-Q1kJ·mol-1,
 H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)= Na2SO4(aq)+H2O(l); △H= -Q2 kJ·mol-1
Na2SO4(aq)+H2O(l); △H= -Q2 kJ·mol-1
HNO3(aq)+KOH(aq) KNO3(aq)+H2O(l); △H= -Q3 kJ·mol-1,则Q1、Q2、Q3的关系正确的是 ( )
KNO3(aq)+H2O(l); △H= -Q3 kJ·mol-1,则Q1、Q2、Q3的关系正确的是 ( )
A.Q1 = Q2 = Q3 B.Q2 > Q1 > Q3
C.Q2 = Q3 > Q1 D.Q2 > Q3 > Q1
14.用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确的是 ( )
A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸
B.锥形瓶用蒸馏水洗净后,润洗后加入一定体积的未知浓度的NaOH溶液
C.滴定时,没有逐出滴定管下口的气泡
D.读数时,视线与滴定管内液体的凹液面最低处保持水平
13.能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是 ( )
(1)将水加热煮沸 (2)向水中投入一小块金属钠
(3)向水中通CO2 (4)向水中通NH3
(5)向水中加入明矾晶体 (6)向水中加入NaHCO3固体
(7)向水中加NaHSO4固体
A.(1)(3)(6)(7) B.(1)(3)(6)
C.(5)(7) D.(5)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com