
7.已知C(石墨,s) = C(金刚石,s) △H>0,P(白磷,s) = P(红磷,s) △H<0。下列判断正确的是 ( )
A.说明金刚石的能量比石墨低 B.说明红磷的能量比白磷低
C.说明红磷比金刚石稳定 D.上述变化为物理变化
6.在2 L的密闭容器中,发生以下反应:2A(g) + B(g) 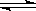 2C(g) + D(g)。若最初加入的A和B都是4 mol,在前10 s A的平均反应速度为0.12 mol/(L·s),则10 s时,容器中B的物质的量是 ( )
2C(g) + D(g)。若最初加入的A和B都是4 mol,在前10 s A的平均反应速度为0.12 mol/(L·s),则10 s时,容器中B的物质的量是 ( )
A.1.6 mol B.2.8 mol C.2.4 mol D.1.2 mol
5.120℃,已知2g氢气点燃后生成水放热235 kJ,下列热化学方程式正确的是 ( )
A.H2(g) + 1/2O2(g)=H2O(l) △H=+ 235 kJ·
B.2H2(g) + O2(g)=2H2O(g) △H=-235 kJ·
C.H2(g) + 1/2O2(g)=H2O(g) △H=-235 kJ·
D.2H2(g) + O2(g)=2H2O(l) △H=-470 kJ·
4.下列反应为吸热反应的是 ( )

3.下列说法正确的是 ( )
A.需要加热的化学反应都是吸热反应
B.C(s) + 1/2O2(g) = CO(g) △H =-110.5 kJ/mol,则石墨的燃烧热为110.5 kJ/mol
C.1 mol/L醋酸和1 mol/L NaOH溶液中和所放出的热量可能大于1 mol/L盐酸和1 mol/L NaOH溶液中和所放出的热量
D.中和反应放热说明反应物(酸和碱)的总能量低于生成物(水和盐)的总能量
2.氢能是一种既高效又清洁的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括 ( )
①原料来源广 ②易燃烧、热值高 ③储存方便 ④制备工艺廉价易行
A.①② B.①③ C.③④ D.②④
1.下列说法正确的是 ( )
A.化学反应一定伴随热量的变化
B.反应热产生的原因在于生成物与反应物的总能量不同
C.活化能越大的化学反应其反应热也越大
D.放热反应是由于断开旧键所需的能量大于生成新键所放出的能量
12.(13分)有机物 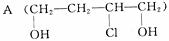 是合成高分子化合物HPMA的中间体,HPMA可用于锅炉阻垢剂。
是合成高分子化合物HPMA的中间体,HPMA可用于锅炉阻垢剂。
(1)有机物A能够发生的反应有: (填写字母)
a.取代反应 b.加成反应 c.消去反应 d.酯化反应
(2)有机物A在Cu做催化剂和加热条件下,与氧气反应生成有机物B。B中含有的官能团除-Cl以外,还含有的官能团是: (写名称和结构简式)
(3)有机物B经氧化后生成有机物C,C可有如下图所示的转化关系:
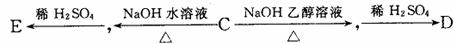
写出E的结构简式: ;
(4)D在高温、高压和催化剂作用下反应生成HPMA写出反应的化学方程式:
;
(5)F是E的一种同分异构体。0.1molE与足量NaHCO3反应放出2.24LCO2(标准状况下);0.1molF与足量金属Na反应放出3.36LH2(标准状况下);F能发生银镜反应。F的结构简式可能是: 。
11.(16分)中学化学常见的物质A、B、C、D之间存在如下转化关系:A+B→C+D+H2O(没有配平)。请按要求填空:
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体。C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式是
,鉴别这两种气体不能选用的试剂是 。
a.BaCl2溶液 b.KMnO4溶液
c.品红溶液 d.酸化的Ba(NO3)2溶液
向500mL2mol/L的NaOH溶液中通入0.8mol无色无味的C气体,恰好完全反应,该反应的化学方程式是 。此时溶液中的离子按照浓度由大到小排列的顺序是 。
(2)若A为红色金属单质,与适量B的溶液在常温下恰好完全反应,生成的无色气体C遇空气迅速变成经棕色。若被还原的B物质的量为2mol时,间生C气体的体积是 L(标况)。将生成的红棕色气体通入一个烧瓶里,塞紧瓶塞后,将烧瓶浸入冰水中,烧瓶中气体的颜色变浅,请用化学方程式和必要的文字解释颜色变化的原因 。
(3)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;D是漂白粉的成分之一。C发生水解反应的离子方程式是
。
(4)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体。检验A中阴离子的方法是
(简述操作过程及结论)。
10.(17分)某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
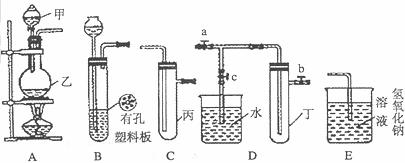
请按要求填空:
(1)A装置中仪器的名称为:甲是 ,乙是 。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
①写出实验室制取Cl2的反应方程式。
。
②若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行I、II两个实验,实验操作、现象、结论如下:
|
实验序号 |
实验操作 |
现象 |
结论 |
|
I |
将氯水滴入品红溶液 |
溶液褪色 |
氯水与水反应的产物有漂白性 |
|
II |
氯水中加入NaHCO3粉末 |
有无色气泡产生 |
氯气与水反应的产物具有较强的酸性 |
请你评价实验I、II的结论是否合理?若不合理,请说明理由:
。
③请利用上述装置设计一个简单的实验,用来验证Cl-和Br-的还原性强弱。(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)
。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
①B中发生反应的离子方程式为 。
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹 ,(填字母,下同)再打开止水夹 ,使烧杯中的水进入试管丁的操作是 。
③利用B装置还可制取的气体有 (写出两种即可)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com