
27.(8分)判断下列过程的△H、△S大于零还是小于零,用“>0”或“<0”填写下列表格。
|
变化过程 |
△H |
△S |
|
NH4NO3溶于水 |
|
|
|
干冰(CO2)的升华 |
|
|
|
4Fe(s) + 3O2(g) = 2Fe2O3(s) |
|
|
|
CaCO3(s)分解为CaO(s)和CO2(g) |
|
|
26.(8分)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后利用得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的化学方程式为:
a.C(s) + O2(g) = CO2(g) △H1
b.C(s) + H2O(g) = CO(g) + H2(g) △H2
H2(g) + 1/2 O2(g) = H2O(g) △H3
CO(g) + 1/2 O2(g) = CO2(g) △H4
回答:
(1)上述四个热化学方程式中哪个△H>0?________________。
(2)理论上等质量的煤分别通过以上两条不同途径产生可利用的总能量的关系是( )
A.a比b多 B.a比b少 C.a与b相同
(3)根据能量守恒定律,△H1、△H2、△H3、△H4之间的关系为 。
(4)与途径a相比途径b有较多的优点,即_________________________________ ______________________________________________________(答出一点即可)。
25.一定条件下,在密闭容器中进行反应:mA(g) + nB(g)  pC(g) + qD(g)。 若增大压强,或升高温度,重新达到平衡,v’正、v’逆随时间变化过程均如图所示,则对该反应叙述正确的是( )
pC(g) + qD(g)。 若增大压强,或升高温度,重新达到平衡,v’正、v’逆随时间变化过程均如图所示,则对该反应叙述正确的是( )

A.正反应是放热反应,m+n<p+q B.逆反应是放热反应,m+n>p+q
C.正反应是放热反应,m+n>p+q D.逆反应是放热反应,m+n<p+q
第Ⅱ卷(非选择题 答案填写在答题纸上)
24.下列措施或事实不能用勒夏特列原理解释的是 ( )
A.新制的氯水在光照下颜色变浅
B.Fe(SCN)3溶液中加入固体KSCN后颜色变深
C.H2、I2、HI平衡混合气加压后颜色变深
D.在合成氨的反应中,加压有利于氨的合成
23.白磷与氧可发生如下反应:P4 + 5O2 = P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P a kJ·mol-1、P-O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。
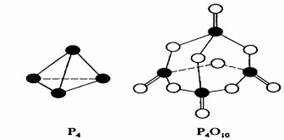
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是 ( )
A.(6a+5d-4c-12b) kJ·mol-1 B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1 D.(4a+5d-4c-12b) kJ·mol-1
22.已知反应A2(g)
+ 2B2(g)  2AB2(g) △H<0,下列说法正确的是 (
)
2AB2(g) △H<0,下列说法正确的是 (
)
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
21.已知次氯酸是比碳酸还弱的酸,反应Cl2 + H2O  HCl + HClO达平衡后,要使HClO浓度增大,可加入 ( )
HCl + HClO达平衡后,要使HClO浓度增大,可加入 ( )
A.HCl B.少量Na2SO4 C.少量NaOH D.CaCO3
20.下列说法正确的是 ( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了单位体积内活化分子的百分数
D.活化分子间所发生的碰撞为有效碰撞
19.100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) 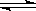 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是 ( )
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是 ( )
①N2O4的消耗速率与NO2的生成速率之比为1∶2;
②NO2的生成速率与NO2消耗速率相等;
③烧瓶内气体的压强不再变化;
④烧瓶内气体的质量不再变化;
⑤NO2的物质的量浓度不再改变;
⑥烧瓶内气体的颜色不再加深;
⑦烧瓶内气体的平均相对分子质量不再变化;⑧烧瓶内气体的密度不再变化。
A.②③⑥⑦ B.①④⑧ C.只有①④ D.只有⑦⑧
18.在一定温度下,向一个容积为2 L的真空容器内(预先装入催化剂)通入1 mol N2和3 mol H2,经过一段时间反应后,测得容器内的压强为起始时的0.9倍。在此时间内H2的平均反应速率为0.1 mol/(L·min),则此反应所经过的时间为 ( )
A.2 min B.3 min C.4 min D.5 min
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com