
4.下列叙述中正确的是 ( )
A.1 mol任何纯净物都含有相同的原子数
B.1 mol O2中约含有6.02 ´ 1023个氧气分子
C.1 mol氢气中含有2 mol氢离子和2 NA个电子
D.阿伏加德罗常数精确值为6.02×1023
3.要除去KNO3溶液中混有的少量Ba(NO3)2杂质,得到纯净的KNO3溶液,操作正确的是 ( )
A.加入适量的Na2CO3溶液,过滤
B.加入足量的K2CO3溶液,过滤
C.先加入过量的K2CO3溶液,过滤,再向滤液中加入适量的稀HNO3
D.先加入过量的K2CO3溶液,过滤,再向滤液中加入适量的稀盐酸
2.现有三组溶液:①汽油和氯化钠溶液、②39%的乙醇溶液、③氯化钠和单质溴的水溶液,分离这三组混合液的正确方法依次是 ( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
1.如图在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是 ( )

A.①加了CCl4 ②加了苯 ③加了酒精
B.①加了苯 ②加了CCl4 ③加了酒精
C.①加了酒精 ②加了CCl4 ③加了苯
D.①加了苯 ②加了酒精 ③加了CCl4
28.(6分)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应。各物质的起始加入量如下:A、B和C均为4.0mol,D为6.5mol,F为2.0mol,设E为x mol。当x在一定范围内变化时,均可通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器正中位置。请填写以下空白:

(1)若x=4.5,则右侧反应在起始时向_________(填“正反应”或“逆反应”)方向进行。欲使起始反应维持向该方向进行,则x的最大取值应小于___________。
(2)若x分别为4.5和5.0,则在这两种情况下,当反应平衡时,A的物质的量是否相等?________________(填“相等”、“不相等”或“不能确定”)。
27.(8分)科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。
(1)一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其计算机模拟图如下。

水 热冰
使水结成“热冰”采用“弱电场”的条件,说明水分子是极性分子。请你展开想象,给“热冰”设计一个应用实例 。
(2)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。
①释放出来的电子可以被若干水分子形成的“网”捕获而形成水合电子,你认为水分子间能形成“网”的原因是 。
②由水分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式 ;该阳离子还能与
水分子作用生成羟基,经测定此时的水具有酸性,写出该过程的离子方程式 。
26.(6分)现将0.4molA气体和0.2molB气体充入10L 的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量的变化如下图:
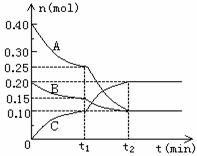
(1)若t1=10min,则0至t1时间内C物质的平均反应速率为 ;该反应在t2时刻达到平衡,则其化学反应方程式为 。
(2)据图中曲线变化情况分析,t1时刻改变的反应条件可能是 。
A.加入了催化剂 B.降低了反应温度
C.向容器中充入了C D.缩小了容器体积
25.(8分)有两种含碳、氢、氧的酯A、B,其组成均为含碳54.5%,含氢9.1%,其密度(蒸气)均为3.94g/L(标准状况),A与B能发生如下反应,经测定,其中B、E、G、H、I能与银氨溶液发生反应并在分子中不含支链.
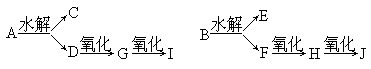
(1)写出下列结构简式和名称
B:________、________; D:_______、________;J:________、________;
(2)写出H与银氨溶液发生反应的化学方程式__ ______。
24.(10)根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含铁、硫两种元素,,其中金属元素的质量分数约为46.7%。

(1)G的化学式为 ;
(2)固体A中所包含的化学键与固体B类似,则A的电子式为 ;
(3)反应②的离子方程式: ;
(4)反应④的离子方程式: ;
(5)已知每生成16 g E,放出106.5 kJ热量,则反应①的热化学方程式为: ;
23.(14)向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y的物质的量浓度变化表示的速率为 mol/L·min。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲v(X)=3. 5mol/L·min; 乙v(Y)=2mol/L·min; 丙v(Z)=4.5mol/L·min; 丁v(X)=0. 075mol/L·s 。若其它条件相同,温度不同,则温度由高到低的顺序是(填序号) 。
(3)若向达到(1)的平衡体系中充入氩气,则平衡向 (填"左"或"右"或"不移动");若向达到(1)的平衡体系中移走部分混合气体,则平衡向 (填" 左 " 或 " 右 " 或 " 不 移动")。
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体,则平衡后X的转化率⑷与⑴的平衡中的X的转化率相比较
A.无法确定 B.⑷一定大于⑴
C.⑷一定等于⑴ D.⑷一定小于⑴
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍与(1)的平衡等效,则a、b、c应该满足的关系为
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com