
14.某反应的离子方程式为Ca2++CO32-==CaCO3¯,对该反应的下列说法不正确的是( )
A.该反应是化合反应
B.该反应一定是复分解反应
C.该反应可能是CaCl2+Na2CO3==CaCO3¯+2NaCl
D.该反应可能是Ca(OH)2+K2CO3==CaCO3¯+2KOH
13.关于胶体和溶液的区别,下列叙述中正确的是 ( )
A.溶液呈电中性,胶体带有电荷
B.溶液中溶质微粒不能通过半透膜,胶体中分散质微粒能通过半透膜
C.溶液中通过一束光线没有特殊现象,胶体中通过一束光线会出现明显的光亮通路
D.溶液是均一的,胶体是不均一的
12.下列关于胶体的说法中正确的是 ( )
A.胶体外观不均匀 B.胶粒做不停的、无秩序的运动
C.胶粒不能通过滤纸 D.胶体不稳定,静置后容易产生沉淀
11.“纳米材料”是粒子直径为l-100 nm(纳米)的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质 ( )
①是溶液 ②是胶体 ③能产生丁达尔效应
④能透过滤纸 ⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀
A.①④⑥ B.②③④ C.②③⑤ D.①③④⑥
10.1 mol Cl2和36.5 g HCl气体相比较,两者的体积关系是 ( )
A.前者大 B.后者大 C.相等 D.不能确定
9.已知25%氨水的密度为0.91 g/cm3,5%氨水的密度为0.98 g/cm3。若将上述两溶液等体积混合,所得氨水溶液的质量分数是 ( )
A.等于15% B.大于15% C.小于l5% D.无法估算
8.用碳酸钠晶体(Na2CO3·10H2O)配制0.5 mol·L-1的Na2CO3溶液l 000mL,假如其它操作均准确无误,下列情况会引起配制的溶液浓度偏高的是 ( )
A.称取碳酸钠晶体100 g
B.定容时,俯视观察刻度线
C.移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗
D.定容时,将容量瓶振荡均匀,静置时发现液面低于刻度线,于是又加入少量水至刻度线
7.今有0.1 mol·L-1的Na2SO4溶液300 mL,0.1 mol·L-1的MgSO4溶液200 mL、0.1 mol·L-1的Al2(SO4)3溶液100 mL,这三种溶液中硫酸根离子的物质的量浓度之比是( )
A.1:1:1 B.3:2:2 C.3:2:3 D.1:1:3
6.从500 mL l mol·L-1的CuSO4溶液中取出100 mL,下列关于100 mL溶液的叙述错误的是 ( )
A.物质的量浓度为l mol·L-1 B.SO42-的物质的量浓度为1 mol·L-1
C.含Cu2+的物质的量为0.1 mol D.含CuSO4的质量为80.0 g
5.设NA为阿伏加德罗常数,标准状况下O2和N2的混合气体m g含有b个分子,则n g该混合气体在相同状况下所占的体积应是 ( )
A. B.
B. C.
C. D.
D.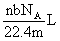
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com