
22.(10分)高铁酸钾(K2FeO4)是一种集氧化、吸附于一体的新型多功能水处理剂。其生产工艺如下:


已知:① 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH → 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为
21.Ⅰ:(6分)三氟化氮(NF3)是一种新型的电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应产物有:HF、NO、HNO3。请根据要求回答下列问题:
(1)写出该反应的化学方程式: 。反应过程中,被氧化与被还原元素的物质的量之比 。
(2)若反应中生成0.2mol HNO3,转移的电子数目为 个。
Ⅱ:(6分)已知反应:① 2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O
② Fe2(SO4) 3+2HI=2FeSO4+I2+H2SO4
③ [ ]K2Cr2O7+[ ]FeSO4+[ ]H2SO4=[ ] Fe2(SO4) 3+[ ] Cr2(SO4) 3+[ ] K2SO4+[ ] H2O
(1)上述三个反应中,属于氧化还原反应的是 (填序号);
(2)配平反应③的化学方程式;
(3)K2Cr2O7、I2、Fe3+三种微粒氧化性由强到弱的顺序: 。
20.室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是 ( )
A.NH4+、Cu2+、Cl-、NO3- B.K+、Na+、SO32-、S2-
C.K+、Na+、AlO2-、SO42- D.Ba2+、Fe2+、NO3-、Br-
第Ⅱ卷(非选择题)
19.铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期。Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag=Tl++2Ag+ 。下列推断正确的是 ( )
A.Tl+的最外层有1个电子 B.Tl3+的氧化性比Al3+弱
C.Tl 能形成+3价和+1价的化合物 D.Tl+的还原性比Ag强
18.有下列四种判断:
①两种弱酸相互反应生成两种强酸;
②两种弱酸盐相互作用后生成两种强酸盐;
③一种弱酸和一种盐溶液作用后,得到一种强酸和一种盐;
④两种酸溶液混合后,溶液的酸性减弱。
其中有具体例证的是 ( )
A.①② B.②③ C.②③④ D.①②③④
17.下列叙述正确的是 ( )
A.酸酐一定是氧化物 B.碱性氧化物一定是金属氧化物
C.金属氧化物一定是碱性氧化物 D.非金属氧化物一定是酸性氧化物
16.下列反应不会有气体产生的是 ( )
A.盐与盐在水溶液中反应
B.强酸与强酸盐一定条件下反应
C.强酸与强碱常温下的中和反应
D.水既不作氧化剂又不作还原剂的氧化还原反应
15.水热法制备Fe3O4纳米颗粒的反应为3Fe2+
+ 2S2O + O2 + xOH-
+ O2 + xOH- Fe3O4+S4O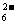 +2H2O,下列说法中,不正确的是 ( )
+2H2O,下列说法中,不正确的是 ( )
A.每生成1mol
Fe3O4,反应转移的电子总数为4mol 
B.Fe2+和S2O 都是还原剂
都是还原剂
C.1mol
Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol 
D.x=4
14.已知下列反应:①NH3+H+ NH4+ ②2Ag++S2-
NH4+ ②2Ag++S2- Ag2S ③Ag++I-
Ag2S ③Ag++I- AgI
AgI
④Ag++ 2NH3  Ag(NH3)2+ ⑤Ag++Cl-
Ag(NH3)2+ ⑤Ag++Cl- AgCl,且前者都比后者更容易发生。下列事实或现象预期正确的是 ( )
AgCl,且前者都比后者更容易发生。下列事实或现象预期正确的是 ( )
A.将氯化钠溶液滴入银氨溶液中有白色沉淀产生
B.将硫化钠溶液滴入银氨溶液中会产生黑色沉淀
C.将盐酸滴入银氨溶液中会不产生白色沉淀
D.将碘化钾溶液滴入氯化银的悬浊液中,不会产生黄色沉淀
13.有一酸性溶液可能含有Br-、SO42-、H2SO3、NH4+ 等微粒,对该酸性溶液分别进行实验:
⑴加热,放出的气体可以使品红溶液褪色;
⑵取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝;
⑶取原溶液加氯水,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列微粒不能确认其在原溶液中是否存在的是 ( )
A.Br- B.SO42- C.H2SO3 D.NH4+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com