

17.(4分)在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8(连二硫酸铵),溶液会发生如下离子反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+。该反应常用于检验Mn2+的存在,其特征现象是________________.若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为________________mol.
16.完全燃烧一定质量的无水乙醇,放出的热量为Q,已知为了完全吸收生成的CO2,消耗掉8mol/L的氢氧化钠溶液50mL,则无水乙醇的燃烧热不可能是 ( )
①8Q ②6Q ③12Q ④4Q
A.①② B.①④ C.②③ D.③④
15.下列各组离子能在指定溶液中共存的是 ( )
①在 溶液中:
溶液中: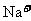 、
、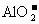 、
、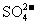 、
、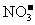
②使pH试纸变深蓝的溶液中: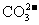 、
、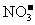 、
、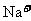 、
、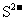 、
、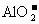 、
、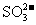
③水电离的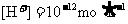 的溶液中:
的溶液中: 、
、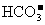 、
、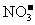 、
、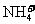 、
、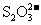
④加入Mg能放出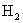 的溶液中:
的溶液中: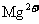 、
、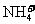 、
、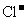 、
、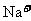 、
、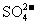
⑤使甲基橙变红的溶液中: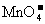 、
、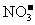 、
、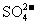 、
、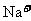 、
、
⑥pH=0的溶液中: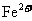 、
、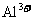 、
、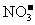 、
、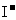 、
、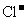 、
、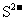
A.①③ B.②④⑤ C.①②⑤ D.③⑥
14.某温度下,反应N2O4(g)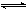 2NO2(g)
△H>0在密闭容器中达到平衡,下列说法中不正确的是 ( )
2NO2(g)
△H>0在密闭容器中达到平衡,下列说法中不正确的是 ( )
A.体积变小时,将使正反应速率增大
B.体积保持不变,加入少许NO2使正反应速率减小
C.体积保持不变,加入少许N2O4,再达到平衡颜色变深
D.体积保持不变,升高温度,再达到平衡颜色变深
13.阿伏加德罗常数为6.02×1023 mol-1。下列叙述中正确的是 ( )
A.标准状况下,2.24L煤油(设为C8H18)中含有4.816×1023个碳原子
B.25℃时,1L 0.1mol·L-1的氢氧化钠溶液中含有6.02×1023个OH-
C.常温常压下,O2和O3的混合物16g中含有6.02×1023个氧原子
D.0.5mol CH4中含有3.01×1023个电子
12.实验室进行NaCl溶液蒸发时,一般有以下操作过程:
①固定铁圈的位置 ②放置酒精灯 ③放上蒸发皿 ④加热搅拌 ⑤停止加热、余热蒸干
其正确的操作顺序是 ( )
A.①②③④ B.①②③④⑤ C.②③①④⑤ D.②①③④⑤
11.已知:H2(g)+I2(g) 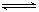 2HI(g)的平衡常数为K1
;1/2H2(g)+
1/2I2(g)
2HI(g)的平衡常数为K1
;1/2H2(g)+
1/2I2(g) 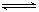 HI(g)的平衡常数为K2,则K1、K2的关系为 ( )
HI(g)的平衡常数为K2,则K1、K2的关系为 ( )
A.K1= 2K2 B.K1= K22 C.K1 = K2 D.K1= K2
10.下列离子方程式正确的是 ( )
A.NaHS水解反应:

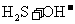
B.石灰石溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
C.Al投入FeCl2溶液中:Al+Fe2+=Al3++Fe
D.往Ba(OH)2溶液中滴入H2SO4溶液:Ba2++SO42-=BaSO4↓
9.某有机物的结构简式为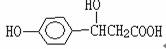 ,它可以发生的反应类型( )
,它可以发生的反应类型( )
(a)取代 (b)加成 (c)消去 (d)酯化 (e)水解
(f)中和 (g)缩聚 (h)加聚
A.(a)(c)(d)(f) B.(b)(e)(f)(h)
C.(a)(b)(c)(d)(f) D.除(e)(h)外
8.短周期元素E的氯化物ECln的熔点为-78℃。沸点为59℃;若以0.2molECln与足量的AgNO3溶液完全反应可以得到57.4g的AgCl沉淀。下列判断错误的是 ( )
A.E是一种非金属元素 B.在ECln中E与Cl之间形成共价键
C.E的一种氧化物为EO2 D.E位于元素周期表的ⅣA族
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com