
2.用玻棒蘸取新制氯水滴在PH试纸中部,观察到的现象是
1.化学与生活、社会密切相关。下列说法正确的是
A.臭氧能对水体消毒,是因为其能杀死水中的病菌
B.执行“限塑令”主要是为了节约资源
C.含磷洗涤剂因为其易被细菌分解,所以不会导致水体污染
D.新装修的住房中放置任何花卉都能降低居室中甲醛含量
31.有10mLNaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液。向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如下图所示。
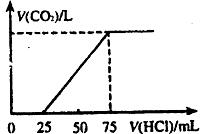
请回答下列问题:
(1)向Na2CO3和NaHCO3的混合溶液中滴加盐酸时发生反应的离子方程式为:
、 。
(2)混合溶液中Na2CO3和NaHCO3的物质的量之比为 。
(3)原NaOH溶液中NaOH的物质的量浓度为 ,所通CO2气体的体积在标准状况下为 。
(4)a mL同浓度的NaOH溶液,与足量的CO2发生反应,得到的溶液中所含溶质的最大质量为 (用含a的数字表示)
30.我国推广食用加碘盐。根据GB5461--《国家食用盐标准》,碘元素含量为20~50mg/kg为合格。质量监督部门为检测某品牌加碘盐是否合格,进行了如下实验:称取250g某品牌加碘盐样品,在酸性条件下用足量KI溶液将其中IO3-全部转化成I2,生成的I2再用0.010mol/L 的硫代硫酸钠溶液滴定,滴定到终点时用去12.00mL。
有关反应如下:
①IO3- + 5I- + 6H+ → 3I2 + 3H2O ②I2 + 2S2O32- → 2I- + S4O62-
(1)用硫代硫酸钠溶液滴定I2时,应用________作指示剂,滴定管,滴定到终点的现象是__________________________。
(2)试通过计算说明该加碘食盐是否为合格产品(写出具体的计算过程)。
29.我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。
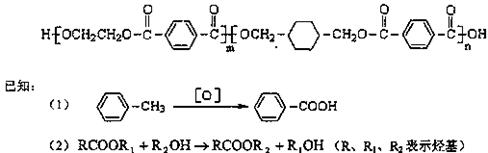
这种材料可采和以下合成路线:
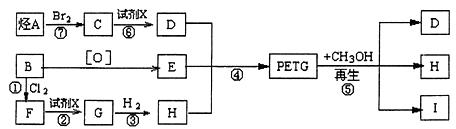
试回答下列问题:
(1)反应②⑥加入的试剂X是 ,⑤的反应类型是 。
(2)写出结构简式:B ,I 。
(3)合成时应控制的单体的物质的量
n(D):n(E):n(H)= : : (用m、n表示)。
(4)写出化学方程式:
反应③: ;
反应6: 。
28.有机物A(C7H11Cl3O2)在NaOH水溶液中加热,生成有机物B和C。
(1)产物B(C4H10O3)分子中含有甲基,官能团分别连在不同碳原子上,它与甘油互为同系物。
①B分子中的官能团名称是 。
②B可能的结构简式为 、 。
③B不可能发生的反应有 。
a.消去反应 b.加成反应 c.水解反应 d.氧化反应
(2)C-F有下图所示的转化关系。C、D、E、F分子中均不含甲基,其中E能跟B发生酯化反应。
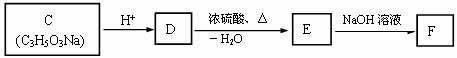
① D的结构简式为_______________________________。
② F在一定条件下可转化为PAAS(高分子化合物,常用作食品增稠剂),该反应的化学方程式为________________________________________________。
(3)若通过实验证明A分子中含有氯元素,所用的试剂有 、 、 。
27.某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了如图所示的装置。已知,二氧化硫遇水生成硫酸并放出大量热,容易形成酸雾。试回答:
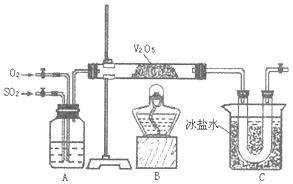
(1)与二氧化硫冒出的气泡A装置可用来观察二氧化硫和氧气的进气量。实验时应使A中氧气导气管冒出气泡的速率相近。其目的是 ,A中的药品是 。
(2)检查完装置的气密性且加入药品后,开始进行实验。此时首先应该进行的操作是
。在实验过程中不能持续加热的理由是 ;
(3)若用ag铜跟足量浓硫酸反应制二氧化硫,实验结束时得到bg三氧化硫,该实验中二氧化硫的转化率不小于 。
(4)老师说该实验装置设计不完整,你认为还缺少 装置,请你协助该研究小组设计出所缺装置 (用简要文字回答)。
(5)标准状况下H2S和O2混合气体100mL,经点燃后反应至完全,所得气体经干燥后,恢复到原来状况时体积为10mL,该10mL气体可能是 。
A.H2S SO2 B.O2 C.H2S D.SO3
26.有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图装置(夹持装置仪器已省略),其实验操作为:先按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象。
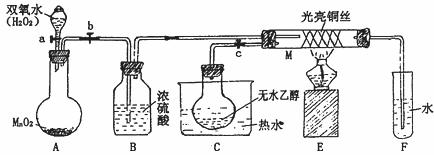
(1)A中发生反应的化学方程式:_______________________________ ,B的作用:_________________________;C中热水的作用:______________________。
(2)M处发生的反应的化学方程式为:_______________________________
(3)从M管中可观察到的现象:_______________________________从中可认识到该实验过程中催化剂_______________________________ (填“参加”或“不参加”)了化学反应,还可以认识到催化剂起催化作用需要一定的__________________ 。
(4)实验乙醇氧化产物的试剂是 ,并写出对应的化学方程式 。
(5)若试管F中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有 。要除去该物质,可现在混合液中加入 (填写字母)。
A.氯化钠溶液 B.苯
C.碳酸氢钠溶液 D.四氯化碳
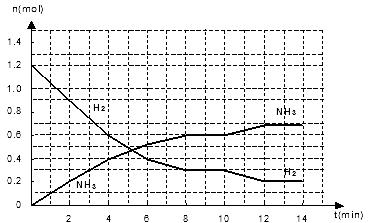
25.一定条件下,在一个体积为10L的固定容器中发生反应:N2(g)+3H2(g)  2NH3(g)+Q(Q>0),发应过程如下图:
2NH3(g)+Q(Q>0),发应过程如下图:
(1)写出该反应的平衡常数表达式K=___________________________;K和反应物的平衡转化率都能表示可逆反应的进行程度。保持温度不变,增大H2的平衡转化率,则K值______(填编号)
a.增大 b.减小 c.不变 d.无法确定
(2)据上图,反应0-2min的v(N2)=_______________mol/(L·min)。
(3)据图判断5min时,V正_______V逆(填大于、小于、或等于,下同);10-12min间, V正_______V逆,可能的原因______________(填编号)
a.升高温度 b.增加H2 c.加入N2 d.移去NH3
(4)若在第10min时压缩容器体积,则平衡将_________移动(填“向左”、“向右”或“不”);达到平衡时c(H2)_______0.03mol/L(填“大于”、“小于”或“等于”)
24.有①、②、③、④、⑤五种元素,①、②、④在周期表中的位置如下图,元素③原子的3p亚层中只有1个电子,元素⑤的最高价氧化物对应水化物是最强的酸。
(1)请在图中用元素符号将③、⑤两元素填写在相对应的位置。(图中实线表示元周期表的部分边界)
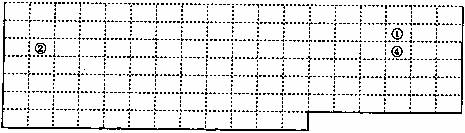
(2)①②两元素形成的化合物的晶体类型是 ,③离子的结构示意图 。
(3)④与⑤两元素气态氢化物的稳定性比较为 > (用化学式表示)
(4)工业上制取①最常见单质的一般方法为 。
(5)能判断两种元素金属性强弱的依据为 (多选扣分)
A.原子得电子吸收能量的多少 B.固态氧化物熔沸点高低
C.反应中原子失电子的难易程度 D.与同浓度盐酸反应的剧烈程度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com