
17.(14分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
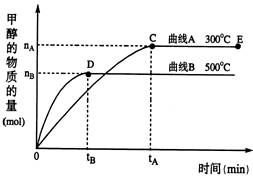
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=______,升高温度,K值____(填“增大”、“减小”、“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=__________________。(用上图中出现的字母表示)
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是______________________。
a.氢气的浓度减小 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_________________________(用化学方程式表示)。
(5)能源问题是人类社会面临的重大课题,甲醇是未来的重要的能源物质。常温下,1g甲醇完全燃烧生成液态水时放出22.7kJ的能量,写出甲醇燃烧热的热化学方程式_________。
16.(9分)“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
c(S2O82-)/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该实验的目的是___________________________________________________。
(2)显色时间t1=_____________________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为_____________________(填字母)。
A.<22.0 s B.22.0-44.0 s C.>44.0 s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是_________________________________。
15.(10分)如下图所示,两烧瓶中充入NO2气体,存在如下平衡:2NO2(g) N2O4(g)△H<0;烧杯甲中盛放100
mL 6 mol·L-1的HCl溶液,烧杯乙中盛放100
mL冷水,现向烧杯甲的溶液中放入25 g
NaOH固体,同时向烧杯乙中放入25 g
NH4NO3固体,搅拌使之溶解。
N2O4(g)△H<0;烧杯甲中盛放100
mL 6 mol·L-1的HCl溶液,烧杯乙中盛放100
mL冷水,现向烧杯甲的溶液中放入25 g
NaOH固体,同时向烧杯乙中放入25 g
NH4NO3固体,搅拌使之溶解。
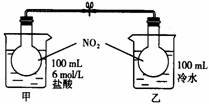
(1)A瓶中气体颜色 ;简述理由 。
(2)B瓶中气体颜色 ;简述理由 。
14.在一定温度下,可逆反应A2(g)+B2(g)
 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
A.A2、B2、AB的浓度不再变化
B.容器中的压强不再随时间变化而变化
C.A2、B2、AB的浓度之比为1:1:2
D.单位时间内生成n mol的A2同时生成2n mol的AB
第II卷(非选择题 共72分)
13.应2X(g)+Y(g) 2Z(g) △H<0。在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示。则下列判断正确的是
2Z(g) △H<0。在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示。则下列判断正确的是
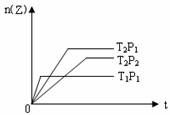
A.T1<T2,P1<P2 B.T1<T2,P1>P2
C.T1>T2,P1>P2 D.T1>T2,P1<P2
12.火箭推进器常以联氨(N2H4)为燃料、过氧化氢为助燃剂。已知下列各物质反应的热化学方程式:
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH1=-533.23 kJ·mol-1
H2O(g)=H2O (l) DH2=–44 kJ·mol-1
2H2O2(l)=2H2O(l)+ O2(g) DH3=–196.4 kJ·mol-1
则联氨与过氧化氢反应的热化学方程式可表示为
A.N2H4(g)+2H2O2(l)= N2(g)+4H2O(l) ΔH=+817.63 kJ·mol-1
B.N2H4(g)+2H2O2(l)= N2(g)+4H2O(g) ΔH=-641.63 kJ·mol-1
C.N2H4(g)+2H2O2(l)= N2(g)+4H2O(l) ΔH=-641.63 kJ·mol-1
D.N2H4(g)+2H2O2(l)= N2(g)+4H2O(g) ΔH=-817.63 kJ·mol-1
11.下列事实能说明CH3COOH为弱酸的是
A.等浓度的HCl、CH3COOH导电能力HCl强于CH3COOH
B.浓度和体积均相等的H2SO4和CH3COOH消耗NaOH的量,H2SO4大于CH3COOH
C.1mol/L的CH3COOH溶液中H+浓度小于1mol/L
D.CH3COOH易挥发
10.把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应:
3X(g)+Y(g) nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/
L·
min,则n的值为
nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/
L·
min,则n的值为
A.4 B.3 C.2 D.1
9.接触法制硫酸通常在400-500℃、常压和催化剂的作用下,用SO2与过量的O2反应生成SO3:2SO2(g)+O2(g) 2SO3(g) △H<0,在上述条件下,SO2的转化率约为90%。但是部分发达国家采用高压条件获得SO3,采取加压措施的目的
2SO3(g) △H<0,在上述条件下,SO2的转化率约为90%。但是部分发达国家采用高压条件获得SO3,采取加压措施的目的
A.发达国家电能过量,以此消耗大量能源
B.高压将使平衡向正反应方向移动,有利于进一步提高SO2的转化率
C.加压可使SO2全部转化为SO3,消除SO2对空气的污染
D.高压有利于加快反应速率,提高生产效率
8.一定条件下,在2SO2+O2
 2SO3的化学平衡体系中,各物质的浓度分别是2.0mol/L、0.8mol/L、2.4mol/L,则氧气在反应起始时的浓度可能是
2SO3的化学平衡体系中,各物质的浓度分别是2.0mol/L、0.8mol/L、2.4mol/L,则氧气在反应起始时的浓度可能是
A.0.8~2mol/L B.0~2mol/L C.0~0.8mol/L D.无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com