
8.对下列各种溶液中所含离子的判断合理的是 ( )
A.向无色溶液中加氯水变橙色,溶液中可能含:SO42-,Br-,OH-,Ba2+
B.在c(H+)=10-14mol/L的溶液中可能含:Na+,AlO2-,CO32-,SO32-
C.在常温下加入铝粉有氢气放出,则溶液中可能含:K+,Na+,H+,NO3-
D.使紫色石蕊试液变红色的溶液中可能含:K+,Na+,Ca2+,HCO3-
7.设NA代表阿伏加德罗常数,下列说法不正确的是 ( )
A.0.012kg13C中碳原子数为NA
B.与S反应时,0.1molCu失去电子数为0.1NA
C.常温常压下,0.5mol CO2分子质量为22g
D.7.8gNa2O2与足量CO2充分反应,转移电子为0.1NA
29.(14分)如下图所示,A(咖啡酸)是某种抗氧化剂成分之一,A与FeCl3溶液反应显紫色。
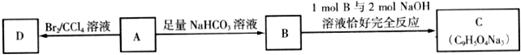
(1)咖啡酸中含氧官能团有___________(填名称)。
(2)咖啡酸可以发生的反应是___________(填写序号)。
①氧化反应 ②加成反应 ③酯化反应 ④加聚反应 ⑤消去反应
(3)咖啡酸可看作1,3,4-三取代苯,其中两个相同的官能团位于邻位,取代基中不含支链。则咖啡酸的结构简式为_________________________________。
(4)3.6g咖啡酸与足量碳酸氢钠反应生成气体___________mL(标准状况)。
(5)蜂胶的主要活性成分为CPAE,分子式为C17H16O4,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇,且分子结构中无甲基,则咖啡酸跟该芳香醇在一定条件下反应字成CPAE的化学方程式为______________________。
28.(16分)我国化学家侯德榜改革国外的纯碱生产工艺制得纯碱,工业生产的纯碱中常含有少量的食盐。某研究性学习小组为测定纯碱中Na2CO3的质量分数,设计了如下图所示的3个实验:
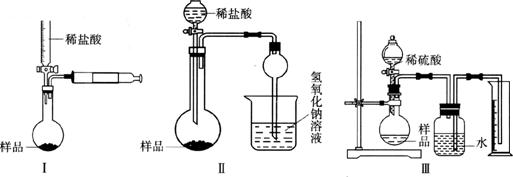
(1)甲同学设计装置如图(Ⅱ)所示,拟通过测定烧杯中氢氧化钠溶液的增重来测定样品中碳酸钠的含量,但该实验存在明显不足,试举出该装置引起误差的两个主要原因:①___________________________;②____________________________。
(2)乙同学设计的测定样品中碳酸钠含量的方法如图(Ⅰ)所示,试回答:
①检查该装置气密性的方法为__________________________________________;
②设滴定管的起始读数为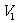 mL,终了读数为
mL,终了读数为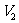 mL,注射器测定排除的气体为
mL,注射器测定排除的气体为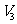 mL(标准状况),称得样品质量为
mL(标准状况),称得样品质量为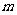 g,则原样品中碳酸钠的质量分数的表达式为______________________(用含
g,则原样品中碳酸钠的质量分数的表达式为______________________(用含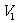 、
、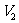 、
、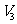 、
、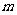 的代数式表示)。
的代数式表示)。
(3)丙同学设计的测定样品中碳酸钠含量的方法如图(Ⅲ)所示,并在广口瓶中的水面上滴加少量植物油,试回答:
①你认为植物油的作用是____________________________________________;
②为减小误差,读取量筒中水的体积时的注意事项有:______________________。
(4)丁同学的方案是:称样品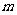 g,并溶解,加过量氯化钡溶液,过滤、洗涤、烘干,称量得固体
g,并溶解,加过量氯化钡溶液,过滤、洗涤、烘干,称量得固体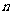 g。
g。
①混合物中碳酸钠的质量分数为___________(用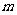 、
、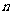 表示);
表示);
②洗涤沉淀的操作要点是____________________________________________。
27.(16分)A、B、C、D、E是原子序数依次增大的五种短周期元素,A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物的化学式为AE,其分子中含18个电子。
(1)由A、B、C三种元素形成的化合物的电子式为___________,这种化合物形成的晶体中所含的化学键类型有___________。
(2)A2B的沸点高于A2D,其原因是________________________________________。
(3)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1︰1︰1。在25℃时,将该盐溶于水,测得溶液pH>7,理由是______________(用离子方程式表示)。
(4)写出两种均含有A、B、C、D四种元素组成的化合物的化学式_____________、_____________,这两种化合物的水溶液发生反应的离子方程式为___________。
(5)用石墨电极电解CE的饱和溶液,反应的离子方程式为_____________________;若反应溶液的体积为200mL,测得pH为13,则阳极得到的气体质量为_________。
26.(14分)已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为气体单质,D为无色气体,在空气中会出现红棕色。各物质的转化关系如下图所示(部分反应产物已略去)。
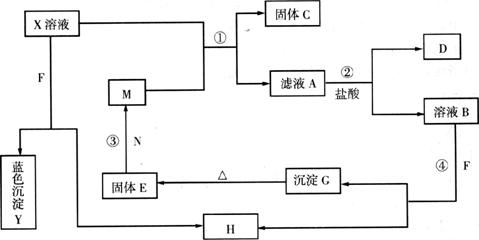
请回答下列问题:
(1)X的化学式为___________。
(2)反应③的主要用途是_________________________________(列举两个)。
(3)在反应①②③④中属于置换反应的是___________(填序号)。
(4)反应②的离子方程式为____________________________________________。
(5)X溶液与F反应的总化学方程式为_________________________________。
(6)若向100mL X盐的溶液中加入10g金属单质M的粉末,充分搅拌后,过滤,烘干得10.16g固体C。则滤液A中溶质的物质的量浓度为___________。(假设溶液体积不变)
13.将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应:

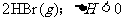 。平衡时Br2(g)的转化率为
。平衡时Br2(g)的转化率为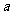 ;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为
;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为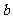 。
。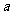 与
与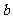 的关系是
的关系是
A.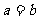 B.
B. C.
C.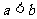 D.无法确定
D.无法确定
第Ⅱ卷(非选择题 共174分)
12.下列溶液中有关微粒的物质的量浓度关系正确的是
A.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):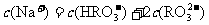
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液: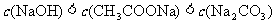
C.PH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸中,由水电离出的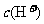 :①>②>③
:①>②>③
D.0.1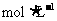 的NaHA溶液,其pH=4:
的NaHA溶液,其pH=4: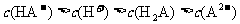
11.用于2008年北京奥运会的国家游泳中心(水立方)的建筑采用了膜材料ETFE,该材料为四氟乙烯与乙烯的共聚物,四氟乙烯也可与六氟丙烯共聚成聚全氟乙丙烯。下列说法错误的是
A.ETFE分子中可能存在“-CH2-CH2-CF2-CF2-”的连接方式
B.合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应
C.聚全氟乙丙烯分子的结构简式可能为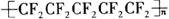
D.四氟乙烯分子中既含有极性键又含有非极性键
10.用NA表示阿伏加德罗常数,下列说法中正确的是
A.1L 1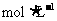 的醋酸溶液中离子总数为2NA
的醋酸溶液中离子总数为2NA
B.标准状况下,11.2L的SO3所含分子数为0.5NA
C.0.4 mol NaCl晶体中含有如下图所示的结构单元的数目为0.1NA
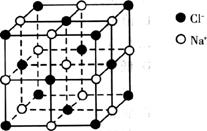
D.9g重水所含有的电子数为NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com