
28.(13分)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:
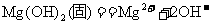 ……①
……①
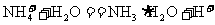 ……②
……②
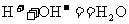 ……③
……③
由于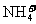 水解显酸性,
水解显酸性,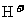 与
与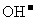 反应生成水,导致反应①平衡右移,沉淀溶解。
反应生成水,导致反应①平衡右移,沉淀溶解。
乙同学的解释是:
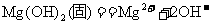 ……①
……①
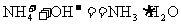 ……②
……②
由于NH4Cl电离出的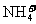 与Mg(OH)2电离出的
与Mg(OH)2电离出的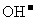 结合,生成了弱的电解质
结合,生成了弱的电解质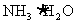 ,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是___________(填写编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
(2)请你说明丙同学做出该选择的理由_________________________________。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解。由此推知,甲和乙哪位同学的解释更合理___________(选填“甲”或“乙”);NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式_________________________________。
27.(16分)某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如下图所示实验:
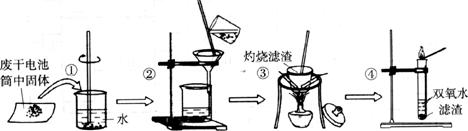
(1)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、___________、___________。
(2)在操作④的试管中加入③中所得滤渣,试管中迅速产生能使带火星的木条复燃的气体,由此推测滤渣含有MnO2,则试管中发生反应的化学方程式为___________ _________________________________。
(3)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中除含有MnO2外,还存在的物质为______________________。
(4)已知氯化锌与稀氨水反应生成Zn(OH)2白色沉淀,而Zn(OH)2可以溶于稀氨水生成可溶性的Zn(NH3)4(OH)2。下面是该同学对操作②的滤液主要成分进行探究的过程:
[猜想Ⅰ]主要成分为氯化铵。
[验证(操作)过程]取少量滤液加入NaOH固体,并加热。
[实验现象]闻到有轻微的氨味。
[判断猜想]____________________(选填“猜想Ⅰ成立”或“猜想Ⅰ不成立”)。
[猜想Ⅱ]主要成分为氯化锌。
[验证(操作)过程]____________________________________________。
[实验现象]_______________________________________________________。
[判断猜想]猜想Ⅱ成立。
由上述实验得出的结论是:滤液中的主要成分是___________________________。
26.(16分)下图是部分常见元素的单质及其化合物的转化关系。(有关反应的条件及生成的部分产物已略去)
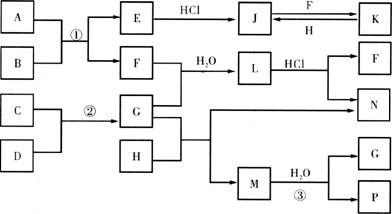
已知:E为红色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态;F、P和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
(1)化合物A中含有的两种元素是___________。
(2)F的化学式为___________;G的水溶液中,最多的阳离子是___________。
(3)写出K与H反应的离子方程式:____________________________________;G与H反应的化学方程式:____________________________________________。
(4)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。使用化学平衡移动原理加以解释______________________。
13.在下列五种实验操作中,主要是为了保证不使液体喷出的是
①加热时试管中盛液量不超过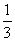 容积
容积
②制溴苯时圆底烧瓶上方要安装一根长玻璃导管
③加热时烧杯内盛液量不超过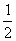 容积
容积
④用高锰酸钾制氧气时试管中靠近试管口处要塞一团棉花
⑤制乙烯时要在烧瓶里放些碎瓷片
A.①②④ B.①③④ C.①③⑤ D.①②⑤
第Ⅱ卷(非选择题 共174分)
12.下列反应产生的气体,通过Na2SO3溶液不反应的是
①Na2O2和CO2 ②Al和NaOH溶液 ③MnO2和浓盐酸 ④浓硝酸和铜片 ⑤铜片和浓硫酸共热 ⑥固体NaCl和浓H2SO4 ⑦FeS和稀硝酸
A.② B.①② C.②⑤ D.全部反应
11.下列各组物质发生化学反应时,由于反应物的量不同而生成不同产物的是 ( )
①CO2与NaOH溶液 ②P与Cl2 ③AgNO3溶液与氨水 ④C与O2
⑤AlCl3溶液与氨水 ⑥C2H2与Cl2 ⑦NaHCO3溶液与盐酸
A.除⑦外 B.除②⑥外 C.除③⑦外 D.除⑤⑦外
10.常温下经测定某溶液中离子只有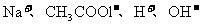 四种,且离子浓度大小的排列顺序为:
四种,且离子浓度大小的排列顺序为: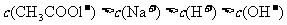 。其可能的情形是
。其可能的情形是
A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.0.1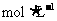 的CH3COOH溶液与0.1
的CH3COOH溶液与0.1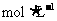 的NaOH溶液等体积混合
的NaOH溶液等体积混合
C.在上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为: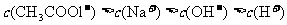
D.该溶液由0.1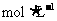 的HCl溶液与等物质的量浓度、等体积的CH3COONa溶液混合而成
的HCl溶液与等物质的量浓度、等体积的CH3COONa溶液混合而成
9.设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.1L pH=1的溶液中含有NA个H+离子
B.100g碳酸钙和碳酸氢钾的混合物中含有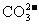 数目为3NA
数目为3NA
C.1mol CH4与l mol SiO2中所含的共价键数目均为4NA
D.3.08g 2CaSO4·H2O晶体中含有结晶水分子数目为0.02NA
8.在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3、各0.01 mol的溶液中加入0.01 mol铁粉,充分搅拌后发生的变化是
A.铁溶解,但没有其他金属析出
B.铁溶解,只析出0.01 mol银
C.铁溶解,析出0.01 mol银和0.005 mol铜
D.铁溶解,只析出0.01 mol铜
7.下列化学用语表示错误的是
A.羟基电子式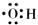 B.镁离子结构示意图
B.镁离子结构示意图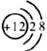
C.次氯酸电子式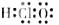 D.氨分子结构示意图
D.氨分子结构示意图
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com