
19.把xmLCO2通过足量的Na2O2后再与ymLNO混合。x与y之和为30mL。设充分反应后气体的体积缩小为15mL,则下列x:y可能的组合为 ( )
①1:1 ②2:1 ③5:4 ④7:5
A.只有①③④ B.只有②③④ C.只有③④ D.①②③④
18.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为 ( )
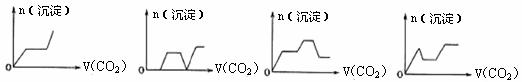
A. B. C. D.
17.在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)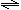 nY(g)△H=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g)△H=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
 |
1L |
2L |
3L |
|
100 |
1.00 |
0.75 |
0.53 |
|
200 |
1.20 |
0.09 |
0.63 |
|
300 |
1.30 |
1.00 |
0.70 |
下列说法正确的是 ( )
A.m>n B.ΔH<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
16.在BrF3+H2O-Br2+HBrO3+O2↑+HF(未配平)化学反应中,若有10.8g水被氧化,则被水还原的BrF3的物质的量是 ( )
A.0.4mol B.0.6mol C.0.8mol D.0.9mol
15. 2SO2(g)+O2(g)
2SO2(g)+O2(g)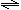 2SO3(g)反应过程的能量变化如图所示。已知生成1molSO3(g)时放出热量99kJ,下列说法正确的是 ( )
2SO3(g)反应过程的能量变化如图所示。已知生成1molSO3(g)时放出热量99kJ,下列说法正确的是 ( )
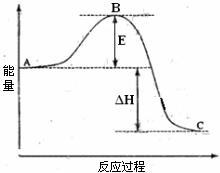
A.图中E表示活化能,ΔH>0
B.若使用V2O5催化剂会使得图中B点降低,C点升高,ΔH的绝对值减小
C.已知单质硫的燃烧热为296kJ·mol-1,则由S(s)生成3molSO3(g)的△H=-1185kJ·mol-1
D.如果反应速率υ(SO3)=0.05mol·L-1·min-1,则υ(SO2)=-0.05mol·L-1·min-1
14.工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)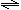 Si(s)+4HCl(g)△H=+QkJ·mol-1(Q>0)
Si(s)+4HCl(g)△H=+QkJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应,下列叙述正确的是
( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH溶液恰好反应
13.下列离子方程式不符合客观事实的是 ( )
A.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:
Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3·H2O+H2O
B.向Na2S2O3溶液中通入足量氯气:
S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
C.向NaAlO2溶液中通入过量的CO2制取Al(OH)3:
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
D.过量的氢氧化钙溶液与碳酸氢镁溶液反应:
Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+2H2O+Mg(OH)2↓
12.元素A的单质及A与B形成的化合物能按如下图所示的关系发生转化。则下列说法正确的是 ( )
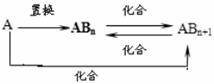
A.当n=1时,A可能是N2
B.当n=2时,A可能是Fe或Al
C.A可能是金属元素或非金属元素
D.图中物质间的转化可能有非氧化还原反应
11.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是 ( )
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
10.一定条件下,N2(g)和H2(g)反应生成2molNH3(g)放出92.4kJ热量。在相同条件下向密闭容器中通入1molN2和3molH2,达到平衡时放出热量为Q1kJ;向另一体积相同的密闭容器中通入0.5molN2、1.5molH2和1molNH3,相同条件下达到平衡时放出热量为Q2kJ。则下列关系式正确的是 ( )
A.2Q2=Q1=92.4 B.Q2<Q1<92.4
C.Ql<Q2<92.4 D.Ql=Q2<92.4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com