
5.通过复习总结,你认为下列对化学知识概括合理的是 ( )
A.氧化物不可能是还原产物,只可能是氧化产物
B.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
D.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
3.最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据。若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是 ( )
A.是一种新的氧化物 B.不可能含有极性键
C.是氧元素的一种同位素 D.是臭氧的同分异构体
|
A.d<c<a<b B.c<d<b<a C.d<a<b<c D.c<d<a<b
2.通过核裂变产生核能可以用于发电,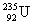 是一种常用的核燃料,下列说法错误的是(
)
是一种常用的核燃料,下列说法错误的是(
)
A.U元素的近似相对原子质量为235 B.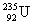 中中子数比质子数多51
中中子数比质子数多51
C.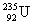 与
与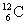 的质量比约为235∶12 D.
的质量比约为235∶12 D.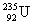 与
与 属于同一种元素
属于同一种元素
1. 目前有研究表明,过氧乙酸对甲型H1N1流感病毒对较好的杀菌作用,这主要是利用了过氧乙酸的 ( )
A.酸性 B.强氧化性 C.还原性 D.挥发性
25.(6分)将不同质量均匀混合的铁、铜粉末分别加入到相同浓度200 mL的稀硝酸中,充分反应后,在标准状况下生成的气体体积与剩余粉末的质量见下表(设硝酸的还原产物只有NO)。
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
粉末的质量 / g |
m1 |
5.28 |
7.92 |
10.56 |
13.20 |
|
剩余粉末质量 / g |
0 |
0 |
0.96 |
3.84 |
6.48 |
|
NO体积 / L |
V1=0.448 |
V2 |
V3=1.792 |
V4=1.792 |
V5=1.792 |
试通过计算填空:
(1)硝酸的物质的量浓度为 ;
(2)通过计算确定粉末中铁、铜的物质的量之比为 ;
(3)通过计算确定实验①中m1的质量为 。(要求写出计算过程,无过程不得分)
24.(14分)现有A、B、C、D、E、F六种易溶于水的强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
NH4+、Na+、A13+、Ag+、Ba2+、Fe2+ |
|
阴离子 |
OH-、C1-、CO32-、NO3-、SO42-、ClO- |
已知:
①B、C两溶液呈强碱性;
②C与D混合直接产生红褐色沉淀;C与F混合产生不溶于稀硝酸的白色沉淀;A与F混合产生白色沉淀和无色气体。
(1)写出下列物质的化学式:
A B C D E F
(2)写出C与D反应的离子方程式
23.(8分)已知周期表中,元素A、B、C、D与元素E相邻,D的最高化合价氧化物的水化物是强酸。C的最高化合价氧化物的水化物是不溶于水可溶于NaOH溶液的白色胶状沉淀。回答下列问题:
(1)C与A可以形成一种耐高温结构陶瓷材料M,其中C为其最高正价,A为其最低负价,请写出M的化学式 ;
(2)A的两种氧化物在常温下一定共生,若快速压缩此共生体系为原体积的1/2,其现象为 ;
(3)这5种元素中分子的立体结构相同的氢化物的沸点从高到低排列次序是(填化学式) ; 电子总数相同的氢化物稳定性由强到弱的顺序为(填化学式) 。
22.(10分)在一定条件下进行的下列化学反应,根据以下的转化关系按要求回答下列问题。

(1)若A、B、C中均含有同一种常见的金属元素X,且①②③均为氧化还原反应,请写出A+C→B反应的离子方程式 ,
并指出元素X在周期表中的位置 。
(2)若化合物A、B、C中均含有同一种常见的金属元素Y,且①②③均为非氧化还原反应,请分别写出两组可能的A、B、C的化学式。(要求B为不同类别的化合物)
第一组:A ,B ,C
第二组:A ,B ,C
(3)若A、B、C中含有同一种常见的非金属元素Z,且①②③均为氧化还原反应, B单质在常温下很难与其它物质发生化学反应,Z的氢化物在同主族元素对应的氢化物中最稳定、沸点最高。请写出A+C→B反应的化学方程式,并用单线桥标明电子转移的方向和数目。
21.(12分)某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数
[方法一]加热转化法
称取a克样品,置于硬质玻璃管中通入足量的氧气加热到质量不再改变。
若冷却后称得固体质量为b克,则样品中Na2SO4质量分数为 ;
[方法二]测 SO2质量法
 采用如图所示装置,通过实验测定生成SO 2的质量。
采用如图所示装置,通过实验测定生成SO 2的质量。
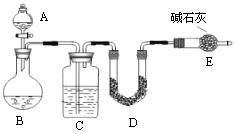
 (1)C中所装药品为
;D中所装药品为
(1)C中所装药品为
;D中所装药品为
 (2)E装置的作用为
(2)E装置的作用为
 [方法三]测沉淀质量法
[方法三]测沉淀质量法
 第一步:称取e克样品,置于小烧杯中;
第一步:称取e克样品,置于小烧杯中;
 第二步:向小烧杯中加入足量稀盐酸,充分反应后加热;
第二步:向小烧杯中加入足量稀盐酸,充分反应后加热;
 第三步:向小烧杯中加入足量BaCl2溶液,然后过滤、洗涤;
第三步:向小烧杯中加入足量BaCl2溶液,然后过滤、洗涤;
第四步:干燥沉淀,称重为f克。
(1)第二步中加热的目的是 。
(2)简述洗涤沉淀的方法:
。
20.如图I所示,甲、乙之间的隔板K和活塞F都可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g) 2C(g),反应达到平衡后,再恢复至原温度,则下列说法正确的是( )
2C(g),反应达到平衡后,再恢复至原温度,则下列说法正确的是( )


A.若达到平衡时,隔板K最终停留在左侧2处,则乙中F最终停留在右侧刻度4处
B.若达到平衡时,隔板K最终停留在左侧1处,则乙中C的转化率小于50%
C.达到平衡时,隔板K最终停留在0刻度左侧的0到2之间
D.如图II所示,若x轴表示时间,则y轴可表示甲、乙两容器中气体的总物质的量或A的物质的量
第Ⅱ卷(非选择题 共50分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com