
5.物质的鉴别有多种方法,下列能达到鉴别目的的是
①用水鉴别汽油、乙醇、苯 ②用相互滴加的方法鉴别Na2CO3 和硫酸溶液
③用加热的方法鉴别NH4Cl和NaHCO3 固体
A.①② B.②③ C.①③ D.①②③
4.若NA表示阿 伏加德罗常数,下列说法正确的是
伏加德罗常数,下列说法正确的是
A.7. 1g Cl2 与足量NaOH溶液反应转移电子数为0.2 NA
B.在25˚C,101KPa时,14 g氮气中含有7 NA个电子
C.在0˚C,101KPa时,含有 NA个氢原子的氢气体积为22 .4 L
D.标准状况下11 .2 LSO3所含的分子数为0 .5 NA
.2 LSO3所含的分子数为0 .5 NA
3.下图是元素周期表的一部分,下列说法中正确的是
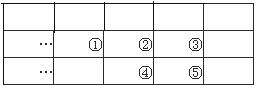
A.元素①位于第二周期第ⅣA族
B.气态氢化物的稳定性:④>②
C.最高价氧化物对应水化物酸性:⑤>④
D.元素的最高正化合价:③=⑤
2.下列表述不正确的是
A.人造刚玉熔点很高,可用作高级耐火材料,主要成分是Al2O3
B.在医疗上碳酸氢钠可用于治疗胃酸过多
C.用于现代通讯的光导纤维的主要成分是高纯度的硅
D.分散系中分散质粒子的直径:Fe(OH)3 悬浊液>Fe(OH)3 胶体>FeCl3 溶液
1.氢化锂、氘化锂、氚化锂在一定条件下都可产生极高的能量,被广泛应用在火箭推进剂和核反应中。下列说法正确的是
A.LiH、LiD、LiT的摩尔质量之比为1:2:3 B.它们都是强氧化剂
C.H、D、T之间互称为同素异形体 D.它们都是强还原剂
30.(13分)为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2 g,用下图所示装置进行实验(铁架台.铁夹等仪器未在图中画出):
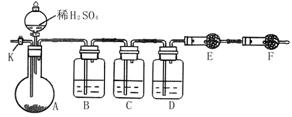
(1)将仪器连接好以后,必须进行的第一步操作是:_____________________。
(2)此实验还必须用到的最重要的仪器是______________________________;仪器F的作用是________________________________________________________。
(3)已知仪器C中装有品红溶液,其作用是________________________________,有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低,理由是_________。
(4)实验室中备有以下常用试剂:
a.浓硫酸; b.品红溶液;
c.酸性高锰酸钾溶液; d.饱和碳酸氢钠溶液;
e.氢氧化钠溶液; f.无水硫酸铜;
g.碱石灰; h.五氧化二磷;
i.无水氯化钙。
请将下列容器中应盛放的试剂序号填入相应空格:
B中_____________,D中______________,E中_____________。
(5)实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中缓慢通入大量的空气。这样做的目的是_________________________________________。所通空气应先经过___________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值_______________(填“偏高”.“偏低”或“没影响”)。
(6)若仪器E在实验完成时增重4.4 g,则Na2CO3与Na2SO3的物质的量之比为____________________。
29.(8分)蓄电池是一种可以反复充电.放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)若此蓄电池放电时,该电池某一电极发生还原反应的物质是___________(填序号)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)假如用此蓄电池分别用来电解以下两种溶液,工作一段时间后蓄电池内均分别消耗0.36 g水,且电解池的电极均为惰性电极,试回答下列问题。
①电解足量M(NO3)x溶液时某一极增加了a g M,则金属M的相对原子质量的计算式为___________________(用a、x表示)。
②电解含有0.01 mol CuSO4和0.0l mol NaCl的混合溶液l00 mL,阳极产生标准状况下的气体______________L;将电解后溶液加水稀释至1 L,此时溶液的pH=__________。
28.(10分)A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。
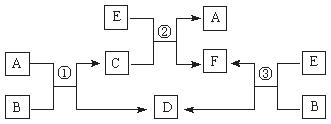
(1)若反应①、②、③均为溶液中的置换反应,A、D、E为第ⅦA族元素单质。则A、D、E的氧化性由强到弱的顺序为(用化学式表示)________________________。
(2)若B是某元素R的氢化物,B的沸点大于与R同主族的其他元素氢化物的沸点,且B在常温下为液态;C是一种有磁性的化合物;E是一种无色.无味的有毒气体。则反应①的化学方程式___________________________________________,③的化学方程式__________________________________________。
(3)若B由短周期元素X.Y组成,且X.Y原子个数比为1∶1,B晶体中既含离子键,又含非极性共价键;绿色植物的光合作用和呼吸作用可实现自然界中D、E的循环。则B的电子式为_____________,反应①的离子方程式___________________。
27.(11分)有A、B、C、D、E五种元素,原子序数依次增大,位于不同的三个短周期,其中B与D为同一主族元素,它们可形成化合物DB2、DB3,在同周期元素中,C的金属性最强,E的非金属性最强;请回答:
(1)写出A、E三种元素的名称:A____________,E_____________。
(2)A、B形成的原子个数比为1∶1的化合物的电子式为__________________,该化合物与DB2化合生成一种强酸的化学方程式为:__________________________。
(3)已知在一定条件下1 mol DB2完全转化为气态DB3,放出98.3 kJ的热量。该反应的热化学方程式是____________________________________________,工业上进行这一反应的设备是_____________,反应的适宜条件为________________________。
(4)用铂作电极电解由C、E形成化合物的饱和溶液时,检验阳极产物的实验方法为______________________________________________________________________;电解一段时间后,将阳极产物和阴极溶液混合,反应的离子方程式是___________________________。工业实际中常采用阳离子交换膜电解槽进行电解,若某一电极由碳钢网制成,则该电极为电解槽的___________(填“阴”或“阳”,下同)极,精制的由C.E形成的化合物的饱和溶液进入_________极室。
26.(8分)在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性为氰化物的千分之一),氰酸盐进一步被氧化成无毒物质。
(1)某厂废水含KCN(其中N的化合价为-3价),其浓度为65 mg/L。现用氯氧化法处理该废水,发生如下反应:KCN+2KOH+Cl2=KOCN+2KCl+H2O,其中被氧化的元素为______________,还原产物为__________。
(2)投入过量的液氯,可将氰酸盐进一步氧化为无毒的稳定物质。在方框内填写生成的无毒的稳定物质的化学式,并在横线上填写配平的化学计量数:
____KOCN+____KOH+____Cl2=____KCl+____CO2↑+____ +___H2O
+___H2O
当反应中生成1 mol CO2时转移的电子总数为 NA。
(3)若处理上述废水20.0 L,使KCN完全转化为无毒物质,至少需要液氯_______g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com