
1.在通常条件下,下列各组物质的性质排列正确的是 ( )
A.熔点:CO2>KCl>SiO2 B.水溶性:HCl>Cl2>SO2
C.沸点:乙烷>戊烷>丁烷 D.热稳定性:HF>H2O>NH3
23.将3.2gCu溶于 过量的硝酸30mL中,假设硝酸的还原产物只有NO和NO2,反应结束后,将所得溶液加水稀释至1000mL,测得c(NO3-)为0.2mol/L。求:
过量的硝酸30mL中,假设硝酸的还原产物只有NO和NO2,反应结束后,将所得溶液加水稀释至1000mL,测得c(NO3-)为0.2mol/L。求:
(1)稀释后溶液中氢离子的物质的量浓度为_____________________;
(2)生成的气体中NO2的物质的量_______________,NO的物质的量为__________(用含a的关系式表示);
(3)用NaOH溶液吸收氮的氧化物是防止NOx污染的一种方法。原理为:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
NO2 + NO + 2NaOH = 2NaNO2 + H2O
若生成的混合气体能被NaOH溶液完全吸收,则a的取值范围为 。
22.Ⅰ.某同学欲测定硫酸铜晶体中结晶水的含量。他列出的实验用品为:硫酸铜晶体试样、托盘天平、研钵、酒精灯、坩埚钳、泥三角、三脚架、玻璃棒、药匙。
回答下面问题:
(1)完成本实验还需要的实验用品有 ;
(2)下面的情况有可能造成测定结果偏低的是 (填序号)。
A.试样中含有易挥发的杂质 B.加热时有晶体溅出
C.晶体加热脱水不完全 D.实验前坩埚未完全干燥
E.硫酸铜受热分解
Ⅱ.该同学发现硫酸铜晶体加热后变黑,查阅资料得知:硫酸铜在加热条件下生成CuO、SO2、O2、SO3。现用下图所示的装置验证硫酸铜在加热分解时有SO2产生,并测量产生O2的体积。
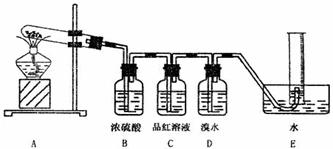
试填写下列空白:
(1)硫酸铜受热分解的化学方程式为 ;
(2)装置B的作用是 ;
(3)写出装置D中发生反应的离子反应方程式 ;
(4)停止加热时,测量收集到的气体体积必须包括以下几步:
①使试管和量筒内的气体都冷却到室温;② ;
③读取量筒内气体的体积。
(5)已知X为ⅥA族元素构成的气态单质,将X和SO2分别通入品红溶液,都能使品红溶液褪色。则X的化学式为 ;简述区别X和SO2的实验方法 。
21.某强碱性溶液中可能含有的离子是K+、NH4+、Al 3+ 、AlO2-、SO42-、SiO32-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液逐滴加入盐酸,现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是_______ ,肯定不存在的离子是_______ _____;
(2)按照反应顺序逐步书写出②中发生反应的离子反应方程式
① ②
③ ④
⑤
20.W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素,Y元素的单质在常温下为淡黄色固体。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐,该反应的离子方程式为
。
(2)X的单质还可以和W的最高价氧化物对应的水化物反应,写出离子方程式 __。
(3)比较Y、Z气态氢化物的稳定性_____>_______(用分子式表示),并用化学反应方程式说明 。
(4)用电子式表示Y的氢化物分子的形成过程 。
(5)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量。写出该反应的热化学方程式:________________ __。
19.某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一。
(1)写出并配平该反应的化学方程式 ;
(2)在该反应中,得电子的物质是 ,被氧化的元素是 ;
(3)在反应中,每转移1 mol电子,消耗HCl mol;
(4)下列叙述正确的是 (填写序号)。
a.在相同条件下,第VIIA族元素的阴离子的还原性从上到下逐渐增强
b.Sn和Pb位于同一主族,其+4价的化合物均很稳定
c.As属于第ⅤA族,这一族元素形成单质的熔沸点从上到下逐渐增强
d.在相同条件下,还原性顺序:S2->I->Fe2+>Br- >Cl-
18.某混合溶液可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现分别取三份溶液进行如下实验:
①第一份加入AgNO3溶液有白色沉淀产生
②第二份加足量NaOH溶液加热后,得到一种刺激性气味的气体
③第三份加足量BaCl2溶液后,得白色沉淀,用足量盐酸洗涤,沉淀部分溶解。
根据上述实验,对原溶液的推测不正确的是 ( )
A.可能含有K+ B.一定不含Ba2+
C.一定含有Cl- D.一定含有CO32-和SO42-
17.a mol FeS与b mol FeO投入到VL、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
( )
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④Vc-(9a+b)/3mol
A.①④ B.②③ C.②④ D.①③
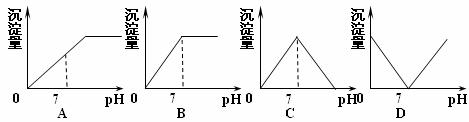
16.向盛有NaHSO4溶液的烧杯中不断滴Ba(OH)2溶液,随着Ba(OH)2溶液的不断滴入,溶液中产生的沉淀量与pH变化情况正确的是 ( )
15.下图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示。下列选项中正确的是 ( )
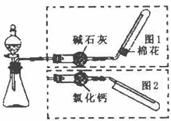
|
|
发生装置的药品 |
干燥和集气装置 |
|
A |
浓硫酸和浓盐酸 |
图1 |
|
B |
大理石和稀盐酸 |
图1 |
|
C |
铜和稀硝酸 |
图2 |
|
D |
氧化钙和浓氨水 |
图1 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com