
22.某溶液中存在XO-3,且X为短周期元素,则一定能在该溶液中大量共存的离子组是( )
A.Na+、H+、SO2-4、I- B.Na+、Ca2+、CO2-3、Al3+
C.Na+、K+、Fe2+、H+ D.K+、SO2-4、Cl-、CO2-3
第Ⅱ卷(非选择题 共80分)
21.常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+===
2Fe3++2H2O;2Fe3++H2O2===2Fe3++O2↑+2H+。下列说法正确的是 ( )
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe2+和Fe3+的总量保持不变
D.生产H2O2过程中需要加入Fe2+
20.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。
湿法制备的主要反应方程式为:2Fe(OH)3+3ClO-+4HO-=2FeO2-4+3Cl-+5H2O
干法制备的主要反应方程式为:FeSO4+2Na2O2=Na2FeO4+Na2SO4
下列有关说法不正确的是 ( )
A.K2FeO4处理水时,不仅能消毒杀菌,还能吸附水中的悬浮杂质
B.湿法中每生成1molNa2FeO4转移3mol电子
C.干法中每生成1molNa2FeO4转移4mol电子
D.高铁酸钾中铁显+3价
19.25°C,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol。下列热化学方程式书写正确的是 ( )
A.2H+(aq)+SO2-4(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l);
△H=-57.3kJ/mol
B.KOH(aq)+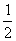 H2SO4(aq)=
H2SO4(aq)=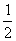 K2SO4(aq)+H2O(l);△H=-57.3kJ/mol
K2SO4(aq)+H2O(l);△H=-57.3kJ/mol
C.C8H18(l)+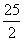 O2(g)=8CO2(g)+9H2O(g);△H=-5518kJ/mol
O2(g)=8CO2(g)+9H2O(g);△H=-5518kJ/mol
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l);△H=-11036kJ/mol
18.如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色。则以下说法不正确的是 ( )
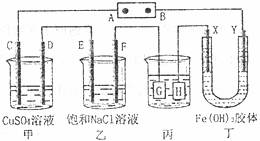
A.电源B极是正极
B.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2
C.欲用丙装置给铜镀银,G应该是Ag,电镀液选择AgNO3溶液
D.装置丁中C极附近红褐色变浅,说明氢氧化铁胶粒吸附正电荷
17.下列各组物质的溶液,不用其他试剂,也不用焰色反应就能将它们区别开来的是( )
A.AgNO3、NaCl、BaCl2、NaOH
B.K2CO3、KHCO3、HCl、H2SO4
C.Na2CO3、NaHSO4、Ba(NO3)2、KCl
D.KNO3、NaCl、BaCl2、(NH4)2SO4
16.参照反应Br+H2
 HBr+H的能量变化示意图,下列叙述正确的是( )
HBr+H的能量变化示意图,下列叙述正确的是( )
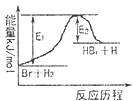
A.该反应的△H=+(E1-E2)kJ/mol
B.加入催化剂,该化学反应的反应热变大
C.反应物的总能量高于生成物的总能量
D.升高温度可增大正反应速率,降低逆反应速率
15.三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有NO、HF、HNO3。则下列说法错误的是 ( )
A.反应过程中,被氧化与被还原的元素原子的物质的量之比为1:2
B.NF3是一种无色、无味的气体,因此NF3在空气中泄漏时不易被察觉
C.NF3泄漏时,可以用NaOH溶液喷淋的方法减少污染
D.若反应中生成1.0molNO,则转移电子的数目约为6.02×10‑23
14.意大利罗马在大兴安岭的Fulvio Cacace等人获得了取具理论研究意义的N4分子。N4分子结构如图所示,已知1molN-N键断裂时吸收167kJ的热量,1molN≡N键形成时放出942kJ的热量。根据以上信息和数据,下列说法正确的是 ( )
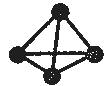
N4分子结构示意图
A.0.1molN4气体转变为气态N2时将放出882kJ的热量
B.N4属于一种新型的化合物
C.N4沸点比P4(白磷)高
D.N4分子是非极性分子
13.下列各组离子在溶液中能大量共存,且此溶液既能与盐酸反应又能与NaOH溶液反应的是 ( )
A.Na+、K+、SO2-4、HCO-3 B.AlO-2、OH-、Na+、Al3+
C.K+、NH+4、NO-3、Cl- D.NH4+、Ag+、NO-3、OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com