

31.盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
____________
30.用电子式表示下列物质的形成过程:
(1)MgCl2:
(2)Br2:
29.从能量的角度看,断开化学键要 ,形成化学键要 。
28.101kPa时,1mol纯物质完全燃烧生成 时所放出的热量,叫做该物质的
燃烧热,单位 。
27.盖斯定律:化学反应的反应热只与反应体系的 和 有关,而与反应的途径无关。
26.在与外界隔离的体系中,自发过程将导致体系的熵 ,(填“增大”、“减小”、“不变”),这个原理也叫做 原理。对于同一种物质, 时熵值最大。
25.已知反应2SO2(g)+O2(g)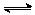 2SO3(g);ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入SO2和O2,在一定条件下发生反应。下图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是( )
2SO3(g);ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入SO2和O2,在一定条件下发生反应。下图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是( )
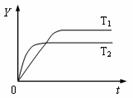
A.SO2的转化率
B.混合气体的密度
C.密闭容器内的压强
D.O2的体积分数
24.可确认化学平衡发生移动的是 ( )
A.化学反应速率发生了改变
B.有气体物质参加的可逆反应达到平衡后,改变了压强
C.由于某一条件的改变,平衡混合物各组分的百分含量发生了改变
D.可逆反应达到平衡后,使用了催化剂
23.由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)。下列推断不正确的是 ( )
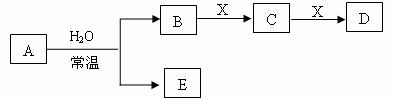
A.若A是单质,B和D的反应是OH―+HCO3― = H2O+CO32―,则E一定能还原Fe2O3
B.若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
C.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
D.若D为CO,C能和E反应,则A一定是Na2O2
22.在密闭容器中发生下列反应aA(g)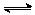 cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是 ( )
cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是 ( )
A.A的转化率变小 B.平衡向正反应方向移动
C.D的体积分数变大 D.a > c+d
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com