
7.在常温下,取浓度相同的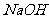 和
和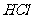 溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为 ( )
溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为 ( )
A.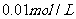 B.
B.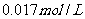
C.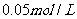 D.
D.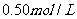
6.下列化合物,按其晶体的熔点由高到低排列正确的是 ( )
A.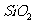 、
、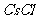 、
、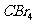 、
、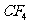 B.
B.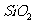 、
、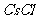 、
、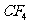 、
、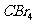
C.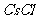 、
、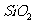 、
、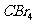 、
、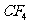 D.
D.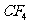 、
、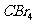 、
、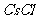 、
、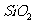
5.空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是 ( )
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防治扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的供应量
4.对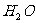 的电离平衡不产生影响的微粒是 ( )
的电离平衡不产生影响的微粒是 ( )
A.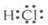 B.
B.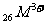
C. D.
D.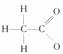
3.下列各组给定原子序数的元素,不能形成原子数之比为1∶1稳定化合物的是 ( )
A.3和17 B.1和9 C.1和6 D.7和12
2.下列叙述中正确的是 ( )
A.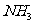 、
、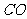 、
、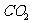 都是极性分子
都是极性分子
B.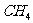 、
、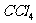 都是含有极性键的非极性分子
都是含有极性键的非极性分子
C.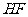 、
、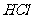 、
、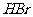 、
、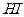 的稳定性依次增强
的稳定性依次增强
D.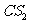 、
、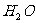 、
、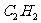 都是直线型分子
都是直线型分子
1.下列叙述不正确的是 ( )
A.北京奥运“祥云”火炬的燃料丙烷(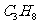 )是化合物
)是化合物
B.用于建设北京奥运主场馆“鸟巢”的钢是纯净物
C.发射“嫦娥”卫星的火箭推进剂中的四氧化二氮(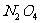 )是氧化物
)是氧化物
D.抗冰雪灾害时使用的融雪剂所含的氯化钠、氯化镁、氯化钙属于盐
34.将N2和H2按一定比例混合,其密度是相同状况下H2的3.6倍,取出0.5mol该混合气体充入密闭容器里,发生反应N2(g)+3H2(g)
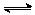 2NH3(g)
△H<0,在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前的0.8倍。试求:
2NH3(g)
△H<0,在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前的0.8倍。试求:
(1)写出此反应的化学平衡常数表达式;
(2)达到平衡时混合气体中氨的物质的量;
(3)平衡时N2的转化率。
33.有A、B、C、D、E、F六种短周期元素,原子序数依次增大,其中A、D元素的原子最外层电子均只有一个电子,且A和D可形成离子化合物;C、F同主族,B元素位于元素周期表中第二周期,且原子最外层电子数占核外电子总数的3/4;F元素原子最外电子层比同周期的E元素原子的最外层多4个电子,请回答:
(1)写出A、D两种元素组成的化合物的电子式 ;
(2)写出B、D、E三种元素组成的常见化合物的名称 ;
(3)工业生产E的化学方程式为 ;
(4)元素F位于元素周期表第 周期,第 族。
(5)D、F两元素最高价氧化物的水化物之间发生的反应的化学方程式
(6)D的氢氧化物和C的氢化物在水溶液中反应的离子方程式为
。
32.在一定条件下,在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧进行如图所示的反应(均加有适量的新型固体催化剂,其体积可忽略不计)
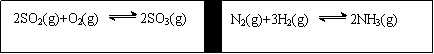

(1)若起始时两边分别投入2 mol SO2、1 mol O2;1 mol N2、3 mol H2,达到平衡后,隔板是否能处于中央 (填“能”或“否”)。
(2)若起始时投入2 mol SO2、1 mol O2;1 mol N2、2 mol H2,达到平衡后,隔板仍处于中央,则SO2的转化率和N2的转化率之比为 (填数字);
(3)若起始时投入2 mol SO2、1 mol O2;1 mol N2、a mol H2、0.1 mol NH3,起始时右侧体积小于左侧体积,当a值在一定范围内变化时,均可通过调节反应器温度,使左右两侧反应都达到平衡,且平衡时隔板处于中央,此时SO2的转化率与N2的转化率之比为5:1,求a的取值范围 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com