
3.12克样品在天平上称量时由于砝码和样品错放位置(5克以下用游码),则该学生称得的读数为 ( )
A.8克 B.10克 C.18克 D.15克
2.有关实验的叙述,正确的是 ( )
A.将固体加入容量瓶中溶解并稀释至刻度,配置成一定物质的量浓度的溶液
B.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH
C.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
D.读取滴定管内液体的体积,俯视读数导致读数偏小
1.下列关于溶液和胶体的叙述,正确的是 ( )
A.溶液是电中性的,胶体是带电的
B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C.溶液中溶质分子的运动有规律,胶体中分散粒子的运动无规律,即布朗运动
D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
33.(4分)难溶电解质在水溶液中存在电离平衡。在常温下FeS的溶度积Ksp=6.25×10-18, 则该温度下,FeS的溶解度是多少?
又知常温下H2S饱和溶液中c(H+)与c(S2-)间存在以下关系:c2(H+)×c(S2-)= 1.0×10-22.在该温度下,将适量的FeS 投入H2S饱和溶液中欲使溶液中,若使c(Fe2+)达到1mol/L,应调节溶液的pH值为多少? (写出必要的计算过程,lg2=0.3)
32.(6分)在25℃时,将0.05mol/L的盐酸与未知浓度的NaOH溶液以1∶2的体积比混合,所得溶液pH值为2。用上述NaOH溶液与某一元弱酸HA 20.0 mL反应,恰好中和时消耗NaOH溶液10.0 mL,所得溶液pH值为10.
(1)c(NaOH) =
(2)c(HA) =
(3)盐类水解程度的大小可用“水解度(h)”来表示。对于NaA型盐的水解度(h)表示为:(已水解的物质的量/原来总物质的量)×100%。则上述所得NaA溶液的水解度(h)为 (写出必要的计算过程)
31.( 11 分)有常见A、B、C三种短周期元素,它们的原子序数依次增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素原子最外层电子数比B元素原子最外层电子数多一个。甲、乙、丙是三种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如图:
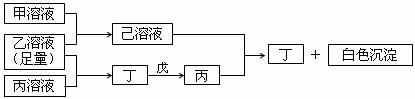
(1)写出C元素的原子结构示意图 ,写出丁和戊的电子式________、________;
(2)用有关化学反应方程式解释:
乙溶液呈酸性的原因: ;
丙溶液呈碱性的原因: ;
(3)写出有关反应的离子方程式:
①乙溶液+丙溶液→丁: ;
②己溶液+丙溶液→丁: .
30.(2分)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是:
A.配制标准溶液的NaOH中混有KOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
29.(9分)甲醛是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定:室内甲醛含量不得超过0.08 mg·m-3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你参与并协助他们完成相关学习任务。
[测定原理]: KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸
4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
[测定装置]:部分装置如下图所示
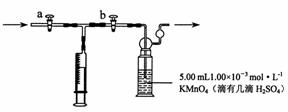
[测定步骤]:
(1)用 ① 量取5.00 mL 1.00×10-3 mol·L-1 KMnO4溶液于洗气瓶中,并滴入几滴稀H2SO4,加水20 mL稀释备用。
(2)将1.00×10-3 mol·L-1的草酸标准溶液置于酸式滴定管中备用;
(3)打开a,关闭b,用注射器抽取100 mL新装修的房屋室内空气。关闭a,打开b,再推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再重复4次;
(4)将洗气瓶中溶液转移到锥形瓶中(包括洗涤液),再用标准草酸溶液进行滴定,记录滴定所消耗的草酸溶液的体积;实验过程是否需要用指示剂 ② ,终点现象是 ② 。
(5)再重复实验2次,(每次所取的高锰酸钾溶液均为5.00mL)。3次实验所消耗草酸溶液的体积平均值为12.38mL。
[交流讨论]:
(1)计算该居室内空气中甲醛的浓度为 ③ mg·m-3,该居室的甲醛 ④ (填“是”或“否”)超标;
(2)某同学用该方法测量空气中甲醛的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设称量或量取、溶液配制及滴定实验均无错误)提出合理假设⑤ 。
(3)实验结束后,该小组成员在相互交流的过程中一致认为:
①实验原理可以简化
实验中无需用草酸标准液滴定,可多次直接抽取室内空气,再压送到洗气瓶中,直至 ⑥ ;记录注射器抽取空气的次数。
②实验装置应加以改进
可将插入KMnO4溶液的导管下端改成具有多孔的球泡(图),有利于提高实验的准确度,其理由是⑦ 。
28.(10分)在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+ B(g) 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
(1)B的平衡浓度为 。
(2)A的转化率为 。
(3)用D表示的平均反应速率为 。
(4)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度 、混合气体平均相对分子质量 。(两空均选填“增大”、“减小”或“不变”)
(5)如果上述反应在相同条件下从逆反应开始进行,开始加C和D各4/3 mol,要使平衡时各物质的质量分数与原平衡时相等,则还应加入 mol B物质。
27.(6分)平衡常数表明了某可逆反应在给定温度下正向进行的程度,对同一类型的反应,平衡常数越大,表明反应进行的程度越大。
H2CO3  HCO3-
+ H+
Ka1(H2CO3)= 4.45×10-7
HCO3-
+ H+
Ka1(H2CO3)= 4.45×10-7
HCO3- 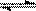 CO32-
+ H+ Ka2(HCO3-) = 5.61×10-11
CO32-
+ H+ Ka2(HCO3-) = 5.61×10-11
HClO 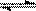 H+
+ ClO-
Ka(HClO)= 2.95×10-8
H+
+ ClO-
Ka(HClO)= 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量氯气通到过量的碳酸溶液中 ;
②氯气和碳酸钠按照1:1的比例恰好反应 ;
③将过量氯气通到少量的碳酸钠溶液中 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com