
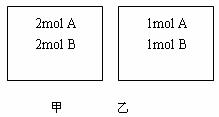
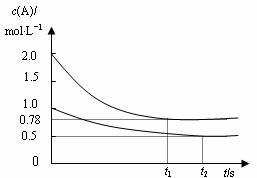
22.向甲乙两个容积均为1L的恒容器中,分别充入2molA、2molB和1molA、2molB。相同条件下,发生下列反应:A(g)+B(g) 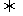 xC(g);△H<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g);△H<0。测得两容器中c(A)随时间t的变化如图所示:
下列说法正确的是 ( )
A.x可能等于2也可能等于3
B.向平衡后的乙容器中充入氦气可使c(A)增大
C.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
D.若向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78 mol/L<c(A)<1.56 mol/L
21.下图所示装置1是一种可充电电池,装置2为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3 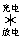 Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是
( )
Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是
( )
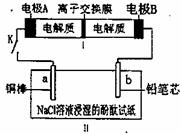
A.负极反应为4Na 4e-=4Na+
4e-=4Na+
B.当有0.01 mol Na+通过离子交换膜时,b电极上析出标准状况下的气体112 mL
C.闭合K后,b电极附近的pH变小
D.闭合K后,a电极上有气体产生
20.质量分数不同的两种硫酸溶液,以相同质量混合时,所得混合溶液密度为ρ1;以相同体积混合时所得混合溶液密度为ρ2。两种浓度不同的氨水溶液,以相同质量混合时,所得混合溶液密度为ρ3;以相同体积混合时,所得混合溶液密度为ρ4,则下列ρ1、ρ2、ρ3、ρ4大小之间关系排列正确的是 ( )
A.ρ1>ρ2>ρ3>ρ4 B.ρ2>ρ1>ρ4>ρ3
C.ρ2>ρ1>ρ3>ρ4 D.ρ2>ρ3>ρ1>ρ4
19.a、b、c、d、e分别为MgCl2、KHSO4、KOH、NaHCO3、AlCl3五种溶液中的一种,其中a能与其余四种溶液反应,且a、d反应时无明显现象;b与d反应只产生气泡;e只能与a反应。下列推理不正确的是 ( )
A.a个一定为KOH溶液 B.b一定为KHSO4溶液
C.c一定为AlCl3溶液 D.e一定为MgCl2溶液
18.镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法正确的是( )
A.电池总反应的离子方程式为:Mg+H2O+2H+=Mg2++2H2O
B.负极的电极反应为:H2O2+2H++2e-=2H2O
C.工作时,正极周围海水的pH减小
D.电池工作时,溶液中的H+向负极移动
17.下列事实,能用勒沙特列原理解释的是 ( )
A.溴水中有下列平衡Br2+H2O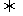 HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g)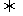 H2(g)+I2(g),达到平衡后增大压强可使颜色变深
H2(g)+I2(g),达到平衡后增大压强可使颜色变深
C.反应CO(g)+NO2(g) CO2(g)+NO(g);△H<0,升高温度使平衡向正反应方向移动
CO2(g)+NO(g);△H<0,升高温度使平衡向正反应方向移动
D.500℃左右比室温更利于合成NH3
16.用石墨做电极,电解氯化铜和氯化钠的混合溶液,在任何情况下,阴、阳两极下不可能同时发生的反应是 ( )
A.阴极:2H++2e-=H2↑ 阳极:4OH--4e-=2H2O+O2↑
B.阴极:2H++2e-=H2↑ 阳极:2Cl--2e-=Cl2↑
C.阴极:Cu2++2e-=Cu 阳极:4OH--4e-=2H2O+O2↑
D.阴极:Cu2++2e-=Cu 阳极:2Cl--2e-=Cl2↑
15.短周期的A、B两种元素,A原子半径小于B的子半径,两种元素可形成A是正价的AB2型化合物。下列关于两元素的叙述正确的是 ( )
①A、B可能属于同一周期 ②A是B的前一周期元素;
③A只能是金属元素; ④A可能是第二周期IIA族或IVA族元素
A.①③ B.②③ C.②④ D.②③④
14.下列热化学方程式书写正确的是(△H的绝对值均正确) ( )
A.C2H5OH(l)+3O2(g)=2CO2(g)+2H2O(g);△H=-1367.0kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)=HCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)=SO2(g);△H=-296.8kJ/mol(反应热)
D.2NO2=O2+2NO;△H=+166.2kJ/mol(反应热)
13.在一定条件下,Ti和I2可以发生如下反应,下列说法正确的是 ( )
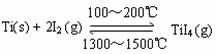
A.该反应△H >0
B.利用该反应可以除去Ti中的Si
C.在100℃时,不可能有Ti的存在
D.增加Ti固体的量有利于平衡向右移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com