
1.下列说法正确的是 ( )
A.H与D、16O与18O互为同位素;H216O、D218O、T2O互为同素异形体;甲醇、乙二醇和丙三醇互为同系物
B.在1个C2H5OH分子中,含有9个共价键
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.由IA族和ⅥA族元素形成的原子个数比为1:1,电子总数为38的化合物,是含有共价键的离子型化合物
29.(15分)元素周期表是学习化学的重要工具,它包含了许多的信息和规律。下表是元素周期表的一部分,请从下表①~⑩十种元素中选择适当的元素回答下列问题:
|
族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
1 |
① |
|
|||||
|
2 |
② |
③ |
④ |
|
⑤ |
⑥ |
|
|
3 |
|
⑦ |
⑧ |
|
|
⑨ |
⑩ |
(1)表中元素形成的四核10电子阳离子的化学式为 ,形成的四核18电子分子的化学式为____ _。
(2)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质,与元素⑦的性质相似的不同族元素是________(填元素符号)。写出元素③的氢氧化物与NaOH溶液反应的离子方程式___ _ 。
(3)某元素原子的次外层为2个电子,其最高正价与最低负价的代数和为2,则该元素的名称是__ __。另有一元素,其原子的核外电子数等于电子层数。这两种元素可以形成多种化合物,其中有一种离子化合物A中两元素的原子个数比为1:5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构。写出A的电子式 。
A物质与水反应生成一种碱和无色气体,写出有关的化学方程式 ,该反应中的还原剂为 。
(4)物质熔沸点的高低与该物质的晶体结构有关。④的单质晶体熔点为2573K,沸点2823K,硬度大,则属于 晶体。某同学猜想⑧和⑩形成的化合物B晶体类型与NaCl相同,则B的熔沸点应 (填“高于”或“低于”)NaCl。如果用实验证明上述猜想不正确,你的实验方案是 。
28.(15分)现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
|
阳离子 |
Ag+
Ba2+ Al3+ |
|
阴离子 |
OH-
Cl-
SO2-4
|
为鉴别它们,分别完成以下实验,其结果是:
a.B和D都不溶于水,也不溶于酸;
b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀
c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀
d.E溶于水后,与上述某阴离子反应可生成B;
e.A溶液与适量E溶液反应生成沉淀,再加过量E溶液,沉淀是减少,但不消失。
请根据上述实验结果,填空:
(1)写出化合物的化学式:A , C ,D ,E 。
(2)A溶液与过量E溶液反应后,最终得到的沉淀的化学式是 。
27.(16分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
26.(14分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反复过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
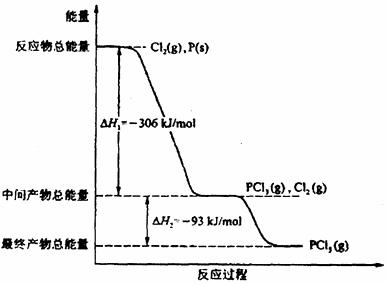
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是 。
(2)PCl5分解成PCl3和Cl2的化学方程式是 。
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80 mol PCl5,反应达平衡时,PCl5还剩0.60 mol,其分解率α1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为a2为,a2 a1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5,原因是 。
(4)P和Cl2分两步反应生成1 mol PCl5的△H3= 。P和Cl2一步反应生成1mol PCl5的△H4 △H3(填“大于”、“小于”或“等于”)
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式: 。
13.下图曲线a表示放热反应X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是 ( )
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是 ( )
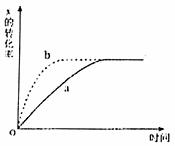
A.升高温度
B.加大X的投入量
C.缩小容器的容积
D.增大容器的体积
第Ⅱ卷
12.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+O2(g)=CO2(g) △H=-393.51 kJ·mol-1
C(金刚石)+O2(g)=CO2(g) △H=-395.41 kJ·mol-1
据此判断,下列说法中正确的是 ( )
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
11.取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现电极与试纸接触处出现一个双色同心圆,内圆为白色,外圆呈浅红色。则下列说法错误的是 ( )

A.b电极是阴极
B.a电极与电源的正极相连接
C.电解过程中,水是氧化剂
D.b电极附近溶液的pH变小
10.用NA表示阿伏加德罗常数的值,下列说法中正确的是 ( )
A.4g重水(D2O)中所含质子数为0.2NA
B.4.48LN2与CO的混合物所含分子数为0.2NA
C.6.2g白磷与红磷的混合物中所含磷原子数为0.2NA
D.12.5mL 16mol·L-1浓硫酸与足量铜反应,转移电子数为0.2NA
9.氨气分子空间构型是三角锥形,而甲烷是正四面体,这是因为 ( )
A.两种分子的中心原子杂化轨道类型不同,NH2为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
D.氨气分子是极性分子而甲烷是非极性分子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com