
3. 能增加反应物分子中活化分子的百分数的是
A.降低温度 B.使用催化剂 C.增大压强 D.增加浓度
2.下列说法正确的是
A.需要加热的化学反应一定是吸热反应
B.绿色化学提倡化工生产提高原子利用率,避免反应中生成有污染的物质
C.H2 →H+H 的变化放出能量
D.鼓入大量空气(远远过量)使燃料完全燃烧,一定提高燃料的利用率
1.下列说法正确的是
A.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
B.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
C.废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源
D.凡含有食品添加剂的食物对人体健康均有害,不宜食用
24.(10分)向300 mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。
请回答下列问题:
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,并分别列出:_______、_______、_______、_______;
(2)若通入CO2气体为2.24 L(标准状况下),得到11.9g的白色固体。
①通过计算确定此白色固体是由哪些物质组成的?其物质的量各为多少?
②计算所用的KOH溶液的物质的量浓度。
1.用下图所示装置进行Mg与SO2反应的实验。
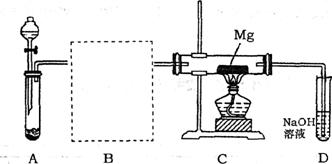
(1)选择制取SO2的合适试剂___________(填编号);
①20%的HNO3溶液②80%的H2SO4溶液③Na2SO3固体④CaSO3固体
(2)在方框中画出B的装置图并注明试剂;
(3)实验后对C装置玻璃管中的固体成分进行分析,未检测到单质硫,则Mg与SO2反应的产物除MgO外另一种是_______ (填化学式),请用实验加以证明______________
Ⅱ.某研究小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:
①工业上在高温时用C还原SiO2可制得Si
②Mg加热的条件下即可与SiO2反应
③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4。
④Si和SiO2均不与稀H2SO4反应
⑤SiH4在空气中自燃
他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,Si的产率也只有预期值的63%左右”。
(4)该小组“实验室制Si”的化学方程式是_______________________________;
(5)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是_________(用化学方程式表示)。
23.(11分)已知SO4、SiO2、CO2等氧化物化学物质具有一定的相似性。
22.(6分)NaCO3粉末中含有少量的NaOH和NaCl。为检验其中的OH-和Cl-,某同学设计的实验分为了7个步骤,其中的6个步骤所用的试剂及实验操作均已写明。
试将下表里尚缺的步骤中所用的试剂(自选)及实验操作补写完整,然后按实验步骤的顺序以数字“1-7”分别填入相应的“实验步骤”栏里。
|
实验步骤 |
所用实验试剂及操作 |
|
( ) |
取少量样品放入试管甲中 |
|
( ) |
再向溶液里滴加几滴AgO3溶液,观察现象 |
|
( ) |
过滤,取少量滤液加入试管乙里 |
|
( ) |
向试管中加入适量的蒸馏水,振荡 |
|
( ) |
滴加几滴酚酞试液,观察现象 |
|
( ) |
滴加硝酸钡溶液至不再产生沉淀为止 |
|
(
) |
|
21.(8分)字母A-K各表示一种物质,其转化关系如图所示,有的反应在溶液中进行,有的反应部分产物已略去。其中E、F、K为单质。其它均为化合物;A、E、K为无色气体,B为淡黄色固体,C为无色液体;F为常见的金属,高温下与某些金属氧化物反应,是工业上冶炼金属的方法之一。
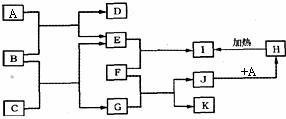
试回答下列问题:
(1)写出下列物质的化学式:A_______,F_______;
(2)A和B反应的化学方程式为______________________;
(3)F和G的溶液反应的离子方程式为________________________________ ;A和J的溶液反应的离子方程式为____________________。
20.(8分)短周期的四种元素A、B、C、D,原子序数依次增大,A、B、C三种元素原子核外电子层数之和是5,A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外层电子数是它的电子层数的2倍,A和C可以形成化合物CA3;B和D的原子序数之比为3:4。
(1)A的元素符号为________,C的元素符号为_______,D的简单离子的离子结构示意图为_______,B2A2的电子式为_______;
(2)上述四种元素中原子半径最大的是____________(用元素符号表示);
(3)写出两种由上述四种元素组成的无机物的化学式___________________。
19.(11分)某实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡,溶液呈黄色。
(1)提出问题
Fe3+、Br2谁的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含___________(填化学式,下同)所致;
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含__________所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a.酚酞试液;b.CCl4;c.无水酒精;d.KSCN溶液;
请你在下表中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)。
|
|
选用试剂 |
实验现象 |
|
方案1 |
|
|
|
方案2 |
|
|
(4)结论
氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入l-2滴溴水,溶液呈黄色所发生的离子反应方程式为_________。
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是__________(填离子符号);
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),若溶液中有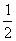 的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_____________。
的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com