
23.铅蓄电池放电时发生下列变化:
负极Pb+SO42-=PbSO4+2e-,
正极4H++ SO42-+PbO2+2e- =PbSO4+2H2O。使用该电池来电解硫酸铜溶液,要得到纯铜1.6g,需消耗该蓄电池内硫酸
A.0.05mol B.0.25mol C.0.1mol D.1mol
第二卷(非选择题,共41分)
22.下列叙述中,正确的是
A.钢铁腐蚀的负极反应为:Fe-3e-=Fe3+
B.Mg-Al及NaOH溶液构成的原电池中负极材料为Mg
C.无隔膜电解饱和NaCl溶液所得产物之一是“84”消毒液中的有效成分
D.H2-O2燃料电池中电解液为H2SO4,则正极反应式为:O2+4e-=2O2-
21.一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A.以X浓度变化表示的反应速率为0.001mol/(L·S)
B.将容器体积变为20L,Z的平衡浓度变为原来的
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的△H>0
20.可逆反应:mA(g) + nB(g)  pC(g) + qD(g); △H= Q,在温度T1、T2,压强P1、P2下,产物D的物质的量n (D)与反应时间t的关系如图所示,下列各项中不正确的是
pC(g) + qD(g); △H= Q,在温度T1、T2,压强P1、P2下,产物D的物质的量n (D)与反应时间t的关系如图所示,下列各项中不正确的是
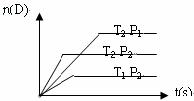
A.T1 < T2 B.P1 < P2 C.m + n<p + q D.Q < 0
19.在一密闭的容器中充入2mol A和1mol B发生反应:2A(g)+B(g) x C(g),达到平衡后,C的体积分数为w %;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为w %,则x的值为
x C(g),达到平衡后,C的体积分数为w %;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为w %,则x的值为
A.只能为2 B.只能为3
C.可能为2,也可能为3 D.无法确定
18.在其它条件一定时,图中曲线表示反应2NO(g) + O2(g) 2NO2(g) △H>0 达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且V正>V逆的点是
2NO2(g) △H>0 达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且V正>V逆的点是
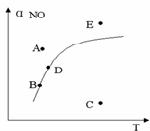
A.A或E B.C点 C.B点 D.D点
17.已知充分燃烧乙炔气体生成1 mol二氧化碳气体和液态水时,放出b kJ热量。则能够表示乙炔燃烧热的热化学方程式是
A.2C2H2(g)+ 5O2 (g)= 4CO2 (g) + 2H2O(l) △H =-2b kJ·mol-1
B.C2H2(g) + 5/2O2(g)= 2CO2(g) + H2O(l) △H = b kJ·mol-1
C.C2H2(g) + 5/2O2(g)= 2CO2(g) + H2O(l) △H =-2b kJ·mol-1
D.2C2H2(g) + 5O2(g)= 4CO2(g) + 2H2O(l) △H =-4b kJ·mol-1
16.高温下,某反应达平衡,平衡常数K=。恒容时,温度升高,H2 浓度减小。下列说法正确的是
A.恒温恒容下,增大压强,H2浓度一定减小
B.该反应的焓变为正值
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO + H2O CO2
+ H2
CO2
+ H2
15.下列事实中不能用勒夏特列原理来解释的是
A.工业接触法制硫酸的过程中通入足量的空气,可以提高SO2的转化率
B.溴水中有下列平衡:Br2+H2O HBr+HBrO,当加入AgNO3溶液后溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后溶液颜色变浅
C.恒温、固定容积的密闭容器中充入的NO2越多,NO2转化成N2O4的转化率越大、平衡浓度也越大
D.工业合成氨选择催化剂的反应条件
14.在一定温度下,可逆反应N2+3H2 2NH3达到平衡的标志是
2NH3达到平衡的标志是
A.1个N≡N键断裂的同时,有6个N-H键生成
B.N2、H2、NH3的体积分数不再变化
C.N2、H2、NH3的物质的量浓度相等
D.N2、H2、NH3的分子数之比为1:3:2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com