
4.下列叙述正确的是(有N4代表阿伏加德罗常数的值) ( )
A.2.7g金属铝变为铝离子时失去的电子数为0.3NA
B.标准状况下,5.6L一氧化氮和5.6L氧气混合后的气体中分子总数为0.5NA
C.在标准状况下,体积均为22.4L的CH4与H2O所含有的电子数均为10NA
D.CO和N2为等电子体,22.4L的CO气体与1molN2所含的电子数相等
3.下列物质能通过化合反应直接制得的是:①FeCl2 ②H2SO4 ③NH4NO3 ④HCl ( )
A.只有①②③ B.只有②③ C.只有①③④ D.全部
2.最近媒体报道了一些化学物质,如:爆炸力极强的N5、比黄金还贵的81O2、太空中的甲醇气团等。下列说法中正确的是 ( )
A.18O2和16O2是两种不同的核素 B.甲醇(CH3OH)属于离子化合物
C.N5和N2是氮元素的两种同位素 D.由N5变成N2是化学变化
1.化学在生产和日常生活中有着重要的作用。下列说法不正确的是 ( )
A.世界各国流通的货质材质一般都是合金,所有的不锈钢中都含有非金属元素
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.工业上用石灰对煤燃烧后形成的烟气进行脱硫,并能回到石膏
D.电解MgCl2饱和溶液,可制得金属镁,镁合金的硬度和强度均高于纯镁
21.某化肥厂生产硝酸铵过程如下:
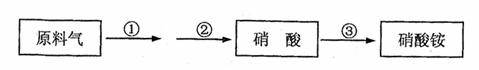
其中反应②为:4NO+3O2+2H2O===4HNO3原料气为氨气和空气的混合物,假设空气中氧气的体积分数为0.2。
(1)写出反应①的化学方程式 。
(2)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中制备硝酸的氨气(不包含第③步被硝酸吸收的氨气)的体积分数最大值为 。
(3)若实际生产中,反应①中氨的转化率(或利用率)为a,反应②中NO的转化率为b,反应③中氨的转化率为c,硝酸完全转化。则生产硝酸的氨气占所用氨气总量的体积分数为多少?在合成硝酸铵的全流程中,氨气的总利用率为多少?
20.向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下左图所示。右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同。已知t3-t4阶段为使用催化剂。
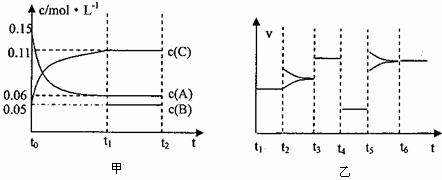
(1)若t1=15s,则t0-t1阶段以C浓度变化表示的反应速率v(C)为= 。
(2)若t2-t3阶段,C的体积分数变小,此阶段v(正) v(逆)(填“>”“<”“=”)
(3)t4-t5阶段改变的条件为 ,B的起始物质量为 。
(4)t5-t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为akJ,写出该反应的热化学方程式 。
19.下图中,B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中最常见的金属单质,J是气态非金属单质。O是白色沉淀且B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品(图中部分反应物和生成物没有列出)。
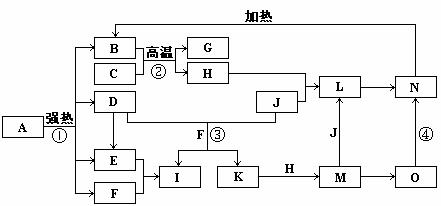
请按要求回答:
(1)H元素在周期表中的位置 。
(2)写出L的化学式 ;
(3)反应③的离子方程式 ;
反应④的化学方程式 ;
(4)反应②在工业生产上的用途是 ;
(5)反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为1∶1∶1∶14,则反应①的化学方程式为 。
18.I 实验室中打开盛有浓盐酸的试剂瓶,瓶口立即产生大量的白雾;把盛有浓氨水的试剂瓶打开,在瓶口却看不到白雾。对此,甲、乙、丙三位同学分别提出如下假设:
甲:NH3与水蒸气的结台能力不如HCl强,瓶口附近形成的氨水小液滴少,达不到肉眼可见的程度。
乙:浓氨水的挥发性不如浓盐酸强.瓶口附近空气中的NH3少.形成的氨水小液滴少.
产生的白雾达不到能被肉眼观察的程度。
丙:NH3的相对分子质量比HCl小,NH3的扩散速率比HCl快,由于挥发出的NH3快速地向四周扩散,形成的氨水小液滴不易集中.所以看不到白雾。
为了验证假设的上的正确性,三位同学在老师的指导下进行了下列实验:
如下图所示-取-根长50cm直径约2cm的玻璃管,水平放置在其两端分别同时塞入蘸有浓盐酸与浓氨水的棉球,立即用橡皮塞塞紧两端。数分钟后,玻璃管中在距离浓盐酸一端约18cm处开始产生白烟。

(1)在进行上述实验之前,甲同学就发现自己假设中的错误,确定甲假设中错误的理由是: 。
(2)上述实验中白烟产生在离浓盐酸一端约18cm处的事实.说明 。所以,关于浓氨水试剂瓶口看不到白雾的原因 的假设是正确的。
Ⅱ 氯化铵除了用作为肥料以外,也用在金属的焊接上,以除去金属表面的氧化物薄层。最近,我国又有学者将氯化铵用于制备无水氯化镁,其流程为:
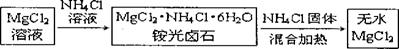
氯化铵的这两项用途也与上述实验中所观察到的现象密切相关。试同答下列问题:
(3)氯化铵的电子式为: 。
(4)在加热条件下氯化铵能除去金属表面氧化物的原因:
(5)在制备无水氯化镁的过程中如果不添加一定量的氯化铵可能造成的结果:
16.BaCl2溶液中通入SO2气体无沉淀产生,若同时将另一种气体A通入BaCl2溶液中,产生白色沉淀,则A可能为 、 (要求填一种化合物和一种单质的化学式)。写出其中化合物A与上述溶液反应的化学反应方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com