
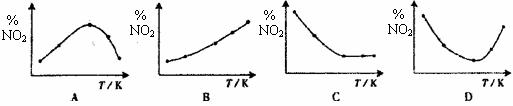
14.取5等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
2NO2(g) N2O4(g),△H<0。反应相同时间后,分别测定体系中O2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是 ( )
N2O4(g),△H<0。反应相同时间后,分别测定体系中O2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是 ( )
第Ⅱ卷(非选择题 共72分)
13.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL4mol/L和稀硝酸,恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热条件下充分还原相同质量的混合物,能得到铁的物质的量为
( )
A.0.24mol B.0.21mol C.0.19mol D.0.14mol
12.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
下列叙述不正确的是 ( )
A.放电时负极反应为:Zn-2e-+2OH-===Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-===FeSO2-4+4H2O
C.放电时每转移3mol电子,正极有1molK2FeSO4被氧化
D.放电时正极附近溶液的碱性增强
11.下列离子方程式书写正确的是 ( )
A.过量氯气通入溴化亚铁溶液中:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2
B.足量二氧化碳通入偏铝酸钠溶液中:CO2+2H2O+AlO-2=Al(OH)3↓+HCO-3
C.在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合:
NH+4+HSO-3+2OH-=SO2-3+NH3+2H2O
D.碳酸氢镁溶液中加入过量石灰水:
Mg2++2HCO-3+Ca2++2HO-=CaCO3↓+2H2O+MgCO3↓
10.下列反应中会有沉淀产生的是 ( )
A.将二氧化硫气体通入酸性HMnO4溶液中
B.将二氧化硫气体通入碘水中
C.将二氧化硫气体通入BaCl2溶液中
D.将少量二氧化硫气体通入Ba(OH)2溶液中
9.对于某些离子的检验及结论一定正确的是 ( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有XO2-3
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO2-4
C.加入氯氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH+4
D.加入碳酸溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
8.短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A和C同主族,B原子的最上层电子数等于A原子次外层电子数。下列叙述中正确的是( )
A.原子半径:A<B<C
B.C的氢化物稳定性大于A的氢化物的稳定性
C.三种元素的最高价氧化物对应的水化物均可由化合反应得到
D.高温下,A单质能转换出C单质
不定项选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
7.室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是 ( )
A.NH+4、Cu2+、Cl-、NO-3 B.K+、Na+、SO2-3、S2-
C.K+、Na+、AlO-2、SO2-4 D.Ba2+、Fe2+、NO-3、Br-
6.根据下列实验事实判断所测液体样品最有可能是纯水的是 ( )
A.室温下测定其pH等于7
B.一个标准大气压下测定其沸点为100°C
C.电解,产生H2、O2的体积比为2:1
D.室温时为无色、无味的液体
5.下列现象或事实可有同一原理解释的是 ( )
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.氯水和活性炭使红墨水褪色
C.漂白粉和水玻璃长期暴露在空气中变质
D. 乙炔和乙烯使溴的四氯化碳溶液褪色
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com