

30.将200mL 1mol/L的Ca(HCO3)2溶液与160mL 2mol/L的NaOH溶液在烧杯中混合。求:
(1)生成沉淀多少克?
(2)计算反应后溶液中存在的主要离子的物质的量浓度(体积变化忽略不计)。
(3)在上述反应后的烧杯中(未经过滤)至少加入多少毫升2mol/L的盐酸才能使产生气体达到最大值?
29.1928年,狄尔斯和阿尔德在研究1,3-丁二烯的性质时发现如下反应:
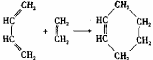 (也可表示为:
(也可表示为: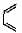 +║→
+║→ )
)
回答下列问题:
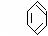
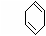
(1)下列具有类似1,3-丁二烯结构的有机物是 (填写序号);


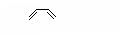
(2)工业上通常以甲醛、乙炔为原料制取1,3-丁二烯,生成流程为:
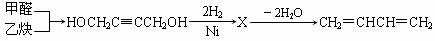
上述流程中甲醛和乙炔的反应类型是 ;X的结构简式为_____ ___。
(3)以CH2=CHCH=CH2、X和HOCH2C≡CCH2OH为原料,合成高分子化合物M的线路如下(羧酸在醇溶液中几乎不和NaOH反应):
有机物C、D中都只含有两种官能团
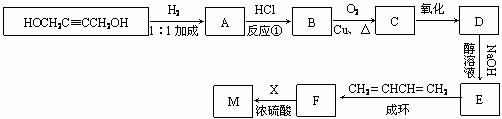
①反应①的目的是 ;
②写出下列反应的化学方程式:B→C ;
F→M 。
③写出下列反应类型:D→E___________________;F→M_____________________。
28.下列是八种环状的烃类物质:
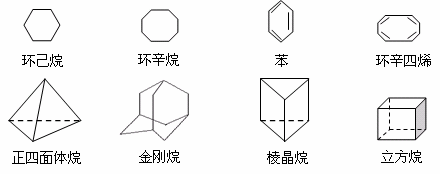
(1)互为同系物的有 和 (填名称)。
互为同分异构体的有 和 . 和 ……
(填写名称,可以不填满,也可以再补充)。
(2)正四面体烷的二氯取代产物有 种;立方烷的二氯取代产物有 种;金刚烷的一氯取代产物有 种。
(3)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):
、 。
(4)以立方烷的一种属于芳香烃的同分异构体为起始物质,通过加成、消去反应可制得苯乙炔(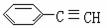 ),写出有关化学方程式(所需的无机试剂自选):
),写出有关化学方程式(所需的无机试剂自选):
; 。
27.乙酸丁酯(CH3COOCH2CH2CH2CH3)是具有果香味的香精,经酯化反应可进行乙酸丁酯的合成。有关物质的物理性质见表。
|
|
乙酸 |
1-丁醇 |
乙酸丁酯 |
|
熔点/℃ |
16.6 |
-89.5 |
-73.5 |
|
沸点/℃ |
117.9 |
117 |
126.3 |
|
密度/ g·cm-3 |
1.05 |
0.81 |
0.88 |
|
水溶性 |
互溶 |
互溶 |
难溶 |
合成过程如下:第一步:将1-丁醇和过量的乙酸混合加热发生酯化反应;第二步:洗涤提纯;第三步:蒸馏提纯。
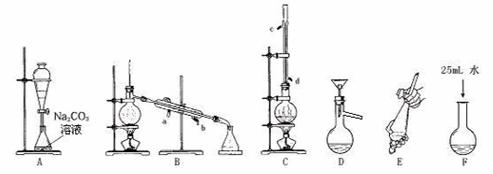
(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)C→F→ → → → 。
(2)C装置中除了装有1-丁醇和过量的乙酸外,还需要加入___ ____.________ 。乙酸过量的原因是____________。装置C中冷凝管的作用是: 。
(3) 步骤F:酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是______ _ __。A装置中Na2CO3溶液的作用是_______ 。
(4) B装置中冷凝水由 口进入 (填a或b) 。
(5)装置A的分液漏斗中液体分为两层,乙酸丁酯应在 (填上.下)层。
(6)第一步酯化反应过程中可能得到的有机副产物有_________________(写出两种物质的结构简式)。
26.某学生做元素性质递变实验时自己设计了一套方案,并记录了有关实验现象如下表
|
实验方案 |
实验现象 |
|
1.用砂纸打磨后的镁带与水反应,再向反应后溶液中滴加酚酞 |
(A) |
|
2.向新制的氢硫酸饱和溶液中滴加新制的氯水 |
(B)产生气体,可在空气中燃烧,溶液变成浅红色 |
|
3.钠与滴有酚酞的试液的冷水反应 |
(C)反应不十分强烈,产生的气体可在空气中燃烧 |
|
4.镁带与2mol/L的盐酸反应 |
(D)剧烈反应,产生可燃性气体 |
|
5.铝条与2mol/L的盐酸反应 |
(E)生成白色胶状沉淀,然后沉淀消失 |
|
6.向氢化铝溶液中滴加氢氧化钠溶液至过量 |
(F)生成黄色沉淀 |
请你帮助该同学完成实验报告:
(1)实验的目的 。
(2)实验仪器:① ② ③ ④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸等。
(3)实验内容:与实验方案1-6对应的实验现象依次为 (填:字母编号)。
实验现象(A)为: 。
(4)实验结论 。
25.在一体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化 如图所示。
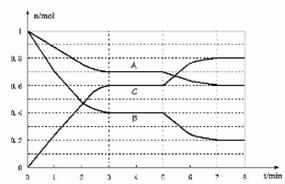
已知达平衡后,降低温度,A的转化率增大。
(1)根据上图数据,从反应开始到达第一次平衡时的平均速率v(A)为 。
(2)写出此反应的平衡常数表达式:K= ;此反应为 (填“吸热”或“放热”)反应。
(3)已知在5~7min内平衡常数K值增大,则此处曲线 s变化的原因是 。
(4)下图表示此反应的反应速率v和时间t的关系图
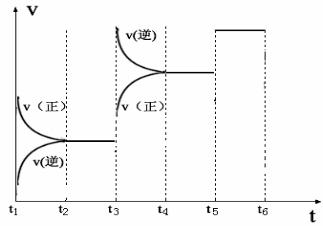
各阶段的平衡常数如下表所示:
|
t2 ~ t3 |
t4 ~ t5 |
t5 ~ t6 |
|
K1 |
K2 |
K3 |
根据上图判断,K1、K2、K3之间的关系为: (用“>”、“<”或“=”连接)。
C的平衡百分含量最高的一段时间是 。
24.(1)请将下列五种物质:KBrO3、Br2 、I2、KI、K2SO4分别填入下列对应的横线上,组成一个未配平的化学方程式:
______+______+ H2SO4 → ______+______+______+KBr +H2O ;
(2)该反应中的氧化产物是 ,被还原的是 中(填写化学式)的 元素(填写元素符号);
(3)如果该反应方程式中I2 和 KBr的系数分别是8和1,则
① Br2的系数是 ;
②请将反应物的化学式及配平后的系数填入下列相应的位置中:
 __________
+
__________
+  __________
+
__________
+  H2SO4 →___________
H2SO4 →___________
③若转移电子总数为10mol,则反应中I2的物质的量为________ 。
23.四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
|
元素 |
T |
X |
Y |
Z |
|
性质 结构 信息 |
原子核外s电子总数等于p电子总数;人体内含量最多的元素,且其单质是常见的助燃剂。 |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼 |
单质质软,银白色固体,导电性强。 单质在空气中燃烧发出黄色的火焰。 |
第三周期元素的简单离子中半径最小 |
(1)写出元素T的离子结构示意图 ;写出元素X的气态氢化物的电子 式 ;写出元素Y的原子最外层电子的轨道表示式 ;写出Z元素原子的核外电子排布式: 。
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式
(3)元素T与氟元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目
22.在一密闭容器中,用一不漏气的滑动活塞隔开,常温时在左边充入3/4体积H2和O2混合气体,在右边充入1/4体积N2。若将左边混合气体点燃充分反应后恢复到原温,活塞停留在中间,则反应前混合气体中H2和O2的体积比可能是 ( )
A.7:2 B.4:5 C.5:4 D.2:7
21.下列各项中的两个量,其比值一定为2:l的是 ( )
A.在反应2 H2S + SO2 → 3 S + 2 H2O中被氧化与被还原的硫原子的质量
B.相同温度下,0.2 mol·L-1 CH3COOH溶液与0.1 mol·L-1 CH3COOH溶液中的
c (H+)
C.在密闭容器中,N2+3H2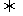 2NH3达平衡时的c(NH3)与c(N2)
2NH3达平衡时的c(NH3)与c(N2)
D.Na2CO3晶体中Na+与CO32-离子个数比。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com