
5.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O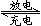 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O
C.放电时每转移3mol电子,正极有1mol K2FeO4被还原
D.放电时正极附近溶液的pH不变
4.下列浓度关系正确的是
A.氯水中:c(Cl2)=2[c(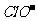 )+c(
)+c(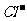 )+C(HClO)]
)+C(HClO)]
B.氯水中:c( )>c(
)>c(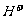 )>c(
)>c(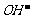 )>c(
)>c(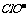 )
)
C.等体积等浓度的氢氧化钠与醋酸混合:c(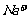 )=c(
)=c(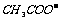 )
)
D.Na2CO3溶液中:c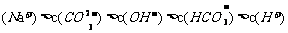
3.出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是
A.锡青铜的熔点比纯铜高
B.在自然环境中,锡青铜中的锡对铜起保护作用
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
2.下列离子方程式正确的是
A.向盐酸中滴加氨水:H+ + OH- = H2O
B.Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
C.铜溶于稀硝酸:3Cu + 8H+ + 2NO3- = 3Cu2+ + 2 NO ↑+ 4H2O
D.向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
1.磷钨酸H3PW12O40等杂多酸可代替浓硫酸用于乙酸乙酯的制备。下列说法不正确的是
A.H3PW12O40在该酯化反应中其催化作用
B.杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质
C.H3PW12O40、KH2PW12O40与Na3PW12O40中都有相同的原子团
D.硅钨酸H4 SiW12O40也是一种杂多酸,其中W的化合价为+8
24.Ⅰ.(2分)用18.4mol/L的浓H2SO4配制100mL浓度为1mol/L的稀H2SO4时,据此填写:
(1)进行量取浓H2SO4操作时,应选择下列量器是 (填序号)
① 10mL量筒 ② 50mL量筒
③ 500mL量筒 ④ 1000mL量筒
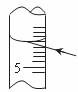
如果对装有浓H2SO4的量筒读数如图所示读取,配制的稀H2SO4的浓度将(填“偏高”、“偏低”或“无影响”)
Ⅱ.(9分)如图是实验室制取某种气体的制备、性质检验及收集装置图。
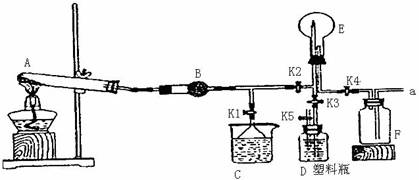
(1)写出图中A中反应的化学方程式:____________________________
写出A中反应物为非金属构成的离子化合物的电子式为______________________
(2)B装置的作用是_______ 。
(3)做喷泉实验前,要检验F装置是否充满气体,该操作及现象是___ ___。
(4)做喷泉实验时要关闭K2和K4,打开K1,此时C装置的作用有两点:
①吸收多余的气体保持气流通畅;②______ ___。
(5)验满气体后, 关闭K2和K4,打开K1。若要在E中引发喷泉,其操作为________;假设液体充满整个烧瓶,所得溶液的物质的量的浓度为____ _
23.(5分)已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去)。
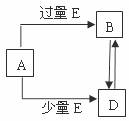
(1)若A和E为单质,组成A单质的元素是自然界中形成化合物种类最多的元素。
①B属于 分子(填“极性”或“非极性”)
②写出由A单质制备两种不同的非金属单质的化学方程式___________________
(2)若A为第三周期中的元素所形成的氯化物。
①写出A溶液→B的离子方程式
②写出A和B的溶液反应的离子方程式 。
22.(6分)A、B、C、D均为短周期主族元素,A、C、D在不同周期,A和C同主族,B、C同周期,A、B、C三种元素的原子序数之和为37,且B元素的最外层电子数与其电子层数相同。请回答:
(1)D元素的名称为 。
(2)元素A、D形成的化合物D2A的熔点比D2C的熔点 (用“高”或“低”填写),理由是(请结合图示说明) 。
(3)A、B、C三种元素所形成的常见化合物溶于水呈酸性,用离子方程式表示其原因 。
(4)A、B、C、D四种元素的简单离子的半径从小到大的顺序是
(用元素符号表示)
21.(15分)
(1)白磷分子中的键角为 ,分子的空间构型为 ,若将1分子白磷中的所有P-P键打开并各插入一个氧原子,共可结合 个氧原子, 若每个P原子上的孤对电子再与氧原子形成配位键,就可以得到磷的另一种氧化物 (填分子式)。
(2)元素周期表是学习化学的重要工具之一,掌握其结构和递变规律是运用周期表的前提。
请按要求回答下列各题:
①写出下面各周期或族所包含的元素种数:第3周期________,第6周期_____ __,Ⅲ B族_________,如果周期表有第八周期,则该周期种元素种数为_________。
②已知A、B分别是周期表中同周期的II A族、III A族元素,原子序数分别为m和n,则n-m的值可能是_________。
(3)经验表明,除氢和氦外,当元素原子的电子层数(n)多于或等于原子最外层电子数(m)即(n-m)≥0时,该元素属于金属元素;当元素原子的最外层电子数(m)多于原子的电子层数(n)即(n-m)<0时,该元素属于非金属元素。试回答:
①第n(n≥2)周期有_______种主族金属元素,有______种非金属元素。
②根据周期表中每个周期非金属的种数,预测周期表中应有_______种非金属元素(含稀有气体),未发现的非金属处在_______周期______族。
20.把x mLCO2通过足量的Na2O2后再与y mL NO混合。x与y之和为30mL。设充分反应后气体的体积缩小为15mL,则x :y为 ( )
① 1 :1 ② 2 :1 ③ 5 :4 ④ 7 :5
A.① B.② C.③ D.①②③④
Ⅱ卷(共54分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com