
8.下列叙述一定正确的是 ( )
A.周期表中同主族元素单质的熔点从上到下逐渐增高
B.HF、HCl、HBr、HI四种物质的稳定性逐渐减弱,但沸点不是依次升高
C.原子晶体中各相邻原子之间都以共价键结台,分子晶体中的每个分子内都含有共价
键
D.干冰和氯化铵分别受热变为气体所克服的粒子间相互作用力属于同种类型
7.设NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.标准状况下,22.4L己炕完全燃烧后生成CO2的分子数为6NA
B.2g金刚石与60g二氧化硅中含有的共价键数均为4NA
C.10L 0.1mol/L硫酸氢铵溶液中所舍NH+4数目一定为NA
D.常温常压下,46g四氧化二氟和二氧化氮的混合物中含有的原子总数一定为3NA
6.在工农业生产和日常生活中有很多化学问题。下列说法正确的是 ( )
A.明矾净水与液氯净水的原理相同
B.将草木灰和硫铵混合施用,肥效更高
C.冬季形成的大雾属于气溶胶
D.电解精炼铜时,同一时间内阴极溶解铜的质量比阳极析出铜的质量小
22.(10分)向amol NaOH溶液中逐滴加入bmol AlCl3溶液,试回答:
(1)依次写出溶液中发生反应的化学方程式。
(2)若a+b=1,当a取不同值时,生成物可能有以下情况:
①全部是Al(OH)3时,a的取值范围是 。
②全部是NaAlO2时,a的取值范围是 。
③部分是NaAlO2,部分是Al(OH)3,a的取值范围是 。反应所生成的Al(OH)3的物质的量为 mol,反应所生成的各物质的总物质的量(包括水)为 mol(用含b的式子表示)。
④在上述条件下,若要生成7.8g沉淀,则a的值等于 或 。
21.(14分)某芳香族化合物A的结构简式是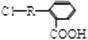 (其中R为饱和烃基),A在一定条件下有如下图所示的转化关系。已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2。
(其中R为饱和烃基),A在一定条件下有如下图所示的转化关系。已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2。
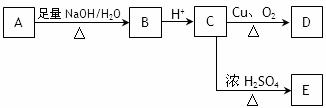
(1)E的分子式是 。
(2)关于上述各步转化中,下列说法正确的是 。
a. 以上各步没有涉及加成反应
b. E比C的相对分子质量小18
c. A、B、C、D中都含有-COOH
d. A与C发生酯化反应后得到的有机物分子式可能是C18H18O4Cl
(3)写出所有符合下列要求的E的同分异构体的结构简式: 、
(①分子中苯环上有三个取代基,且苯环上的一氯代物有两种 ②1 mol该有机物与足量银氨溶液反应能产生4 mol Ag)。
(4)针对以下不同情况分别回答:
①若E能使溴的四氯化碳溶液褪色,还能与NaHCO3溶液反应生成F;D能发生银镜反应。则D的结构简式是 。欲由A通过一步反应得到F,该反应的化学方程式是 。
②若E中除苯环外,还含有一个六元环,则C→E的化学方程式是 。
20.(10分)X、Y、Z为不同短周期非金属元素的气态单质。在一定条件下能发生如下反应: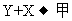 (g),
(g), 。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。
。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。
(1)X的结构式是 。
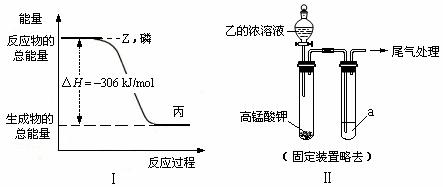
(2)磷在Z气体中燃烧可生成液态丙分子,也可生成固态丁分子。已知丙分子中各原子最外层均是8电子结构,丙的电子式是 。磷单质和Z单质反应生成1 mol丙时,反应过程与能量变化如图Ⅰ所示,该反应的热化学方程式是 。
(3)某同学拟用图Ⅱ所示装置证明氧化性Z>I2,已知高锰酸钾与乙的浓溶液反应生成Z,则a是 的水溶液。若仅将a换为甲的浓溶液,实验时会产生大量白烟并有气体单质生成,该反应的化学方程式是 。
(4)向一定浓度的BaCl2溶液中通入SO2气体,未见沉淀生成,若在通入SO2气体的同时加入由甲和乙中的一种或几种元素组成的某纯净物,即可生成白色沉淀,该纯净物可能是________、________。
19.(8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板的回收利用可实现资源再生,并减污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末是 。
A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(S)+2H+(aq)=== Cu2+(aq)+H2(g) ΔH=64.39kJ·mol-1
2H2O2(I)===2H2O(I)+O2(g) ΔH=-196.46kJ·mol-1
H2(g)+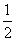 O2(g)===H2O(I) ΔH=-285.84kJ·mol-1
O2(g)===H2O(I) ΔH=-285.84kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
(3)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0 mol·L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率 (×10-3mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(4)在提纯后CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
18.(8分)以氯化钾和钛白厂的副产品硫酸业铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
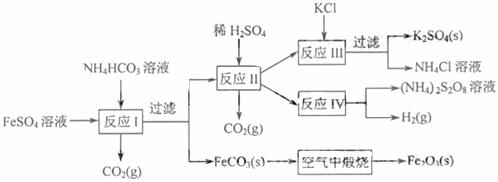
(1)反应I前需在FeSO4溶液中加入__________(填字母),以除去溶液中的Fe3+。
A.锌粉 B.铁屑 C.KI溶液 D.H2
(2)反应Ⅰ需控制反应温度低于35℃,其目的是 。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是 。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为 。
17.(10分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
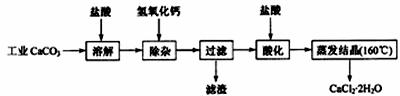
(1)除杂操作是加入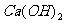 ,调节溶液pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3,是否沉淀完全的实验操作是
。
,调节溶液pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3,是否沉淀完全的实验操作是
。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:
①将溶液中的少量Ca(OH)2转化为CaCl2;
②防止Ca2+在蒸发时水解;③ 。
(3)测定样品中Cl-含量的方法是:a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有_____ _____。
②计算上述样品中CaCl2·2H2O的质量分数为_____ _____。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有 ;_____ _____。
16.实验室将9g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18g,则该氧化物粉末可能是
A.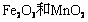 B.
B.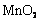 和
和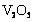 C.
C.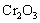 和
和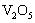 D.
D.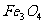 和FeO
和FeO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com