
1.碳酸铵在室温下就能自发地分解产生氨气,对其说法中正确的是 ( )
A.碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大
B.碳酸铵分解的热化学方程式为(NH4)2CO3=NH4HCO3+NH3 △H=+74.9kJ/mol
C.凡是放热反应都是自发的,凡是吸热反应都是非自发的
D.碳酸盐都不稳定,都能自发分解
29.(12分)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3·xH2O),反应的化学方程式:
。
(2)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式 。
(3)下列哪个装置可防止铁棒被腐蚀_____________ 。
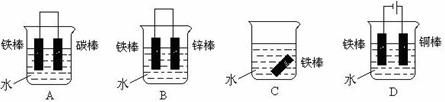
(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:
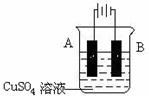
请回答:
①B电极的电极反应式是 。
②若电镀前铁、铜两电极质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为1.92 g,则电镀时电路中通过的电子为________________mol。
(5)钢铁“发蓝”是在钢铁表面形成一层致密的Fe3O4薄膜的技术。共中一种方法是将钢铁制品浸到NaNO2和浓NaOH的混合溶液中加热到130℃。其过程可以用如下化学方程式表示:
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOH
③Na2FeO2+Na2Fe2O4+2H2O=Fe2O4+4NaOH
整个反应过程中,每转移4mol电子。有 g Fe参加反应。
28.(15分)
阿司匹林被誉为“百年新药”,阿司匹林药片的有效成分是乙酰立杨酸,它是一种白色晶体,微溶于水。其结构简式为: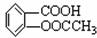 (相对分子质量为180)。
(相对分子质量为180)。
已知:阿司匹林药片中一般添加少量的辅料(都不溶于水,也不与NaOH反应);某课外学习小组为检验阿司匹林有效成分中的官能团并测定乙酰水杨酸在药片中的含量,进行了如下实验:
(1)用氢氧化钠固体配制250mL 0.10mol/L氢氧化钠溶液,完成有关填空。
a.计算所需氢氧化钠的质量;
b.向烧杯中加入适量水,搅拌、使其溶解;
c.用水洗涤烧杯、玻璃棒,洗液注入容量瓶;
d.在托盘天平上通过烧杯称量 g氢氧化钠固体;
e.盖好瓶塞,上下颠倒、摇匀;
f.冷却,将溶液移入250mL容量瓶中;
g.加水至距刻度线1-2cm处改用胶头滴管定容;
h.装瓶、贴上标签、备用
用字母表示正确的配制步骤(只填字母): ;
(2)配制250mL 0.10mol/L盐酸溶液;
(3)取阿司匹林药片于 中研碎,再称量0.3克放入锥形瓶中;
(4)用碱式滴定管取25.00mL 0.10mol/L氢氧化钠溶液(过量)注入上述锥形瓶中并加热、搅拌充分反应。写出反应化学方程式: ;
(5)冷却后,在锥形瓶中加入2-3滴酚酞,用0.10mol/L盐酸滴定未反应的氢氧化钠,左手控制活塞,右手轻摇锥形瓶,眼睛 ,直到溶液变为无色,在半分钟内不复原为止,记录读数。
某学生取等质量阿司匹林完成实验,滴定前后的有关读数记录如下表:用有关数据计算该药片中乙酰水杨酸的质量分数为 ;
|
滴定次数 |
0.1mol/L盐酸读数/mL |
|
|
滴定前 |
滴定后 |
|
|
1 |
0.00 |
17.98 |
|
2 |
1.56 |
16.58 |
|
3 |
0.22 |
15.20 |
(6)不能将阿司匹林溶解于水后直接用NaOH溶液进行滴定的原因是 。
(7)下列操作可能使测定结果(质量分数)偏高的是 。
A.配制盐酸溶液时俯视刻度线定容
B.锥形瓶瓶壁残留蒸馏水
C.滴定前酸式滴定管尖嘴处有气泡,滴定后气泡消失
D.量取氢氧化钠溶液体积时开始时仰视刻度线,结束时俯视刻度线
27.(15分)已知:
(1)CH2=CHCH2CH3+CH2=CHCH2CH3
 CH2=CH2+CH3CH2CH=CHCH2CH3
CH2=CH2+CH3CH2CH=CHCH2CH3
(2)
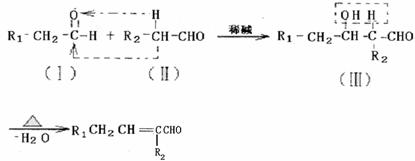
现仅以丙烯为有机原料,经过如下图所示的反应可以分别合成重要的化工原料F和K,用F和K为原料可合成一种链状高分子化合物M,其分子组成为(C12H20O4)n。A的相对分子质量为28。
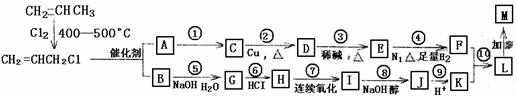
回答下列问题:
(1)反应①的反应类型为 。
(2)不能由物质G直接氧化得到物质K的原因是 。
(3)物质M的结构简式为 。
(4)K分子中存在的官能团有 (写名称),与K具有相同官能团的同分异构体的结构简式为 。
(5)若有1mol 1转化生成J,则消耗NaOH的物质的量为 mol。
(6)写出E与银氨溶液反应的离子方程式:
。
(7)写出反应⑤的化学方程式______________________________________________。
26.(18分)A、B、C、D、E、F六种短周期元素,原子序数依次增大,A、E同主旗,D、F同主族,A元素的原子半径是所有原子中最小的,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E、F五种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)F元素在周期表中的位置 ,写出阴离子B2-2的电子式(用B对应元素的元素符号来表示) 。
(2)常温下,X、Y的水溶液pH均为4,设X、Y水溶液中由水电离出的OH-浓度分别为a、b,则a与b之比为 。
(3)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 。
(4)将铝片和镁片用导线连接,插入由A、D、E三种元素组成的化合物的稀溶液中构成原电池,则负极的电极反应式为 。
(5)A单质与C单质在一定条件下可化合为乙,室温下,向pH=a的乙的水溶液中加入等体积pH=b的X的水溶液,且a+b=14,充分作用后,溶液pH 7(填“>”“<”或“=”)该溶液中各种离子浓度由大到小的顺序为 。
(6)如下图所示,温度不变时某容器分隔I、II两部分,I容积固定不变,II有可移动的活塞,现在I中充入2molFD2和1molD2,在II中充入2molFD3(g)和1molC2,在相同条件下发生可逆反应:2FD2(g)+D2(g) 2FD3(g)。
2FD3(g)。
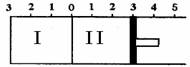
根据下列要求填写空白:
①若固定活塞位置在右侧的3处不动,达到平衡时,设I中压强为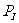 ,II中压强为
,II中压强为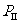 ,则
,则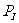 与
与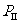 的关系是
的关系是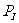 _________
_________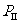 (填“大于”、“小于”或“等于”).
(填“大于”、“小于”或“等于”).
②若要使II中与I中平衡状态相同,可移动活塞的位置应在_____处。(选“2”、“3”或“4”)
③若活塞右移到5处,达到平衡后,I中FD3(g)为x mol,II中FD3(g)为y mol,则x和y的关系是y________x(填“大于”、“小于”或“等于”)。
13.在下列条件下,一定能大量共存的离子组是 ( )
A.在硫酸铝溶液中:Na+、NH+4、HCO-3、Mg2+
B.在水电离出的c(H+)=1×l0-13mol L-1的溶液中:Na+、NH+4、NO-3、CH3COO-
C.含有大量Fe2+的溶液:Na+、Mg2+、NO-3、SO2-4
D.在c(H+)/c(OH-)的比值为1014的溶液:K+、I-、SO2-3、S2-
第Ⅱ卷(非选择题)
12.下列离子反应方程式正确的是 ( )
①四氧化三铁溶于稀硝酸中:Fe3O4+8H+=2Fe3++Fe2++4H2O
②将过量SO2气体通入氨水中:SO2+NH3·H2O==NH+4+HSO-3
③两极均用铁棒电解饱和食盐水:2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
④向醋酸溶液中滴加少量碳酸氢钠溶液:H++HCO-3 ==H2O+ CO2↑
⑤制铁发生吸氧腐蚀正极的电极反应:2H2O+O2+4e-=4OH-
⑥硝酸铁溶液中滴加足量HI溶液:Fe3++3NO-3+12H++10I-=Fe2++5I2+3NO↑+6H2O
A.②⑤⑥ B.①②③⑤ C.①②④⑥ D.②③④⑤⑥
11.在高温和催化剂存在下,向容积为2 L的密闭容器甲加入0 2molCO和0.2 mol H2O,发生如下反应CO(g)+H2O(g) CO2(g)+H2(g),△H=-akJ/mol(a>0)。反应达到平衡后,测得c(CO):c(CO2)=3:2。下列说法正确的是 ( )
CO2(g)+H2(g),△H=-akJ/mol(a>0)。反应达到平衡后,测得c(CO):c(CO2)=3:2。下列说法正确的是 ( )
A.反应放出的热量为0.2a kJ
B.若升高温度,v(正)减慢,v(逆)加快,平衡逆向移动
C.若将容器的体积压缩为1L,H2的体积分数变为40%
D.平衡时H2O的转化率为40%
10.常温下,下列两种溶液混合后,所得溶液中有关微粒的物质的量浓度关系正确的是( )
A.pH=3的硫酸溶液和pH=11的氨水等体积混合:c(SO2-4)>c(NH+4)>c(H+)>c(OH-)
B.0.2mol·L-1的HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,已知PH>7,则c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+)
C.0.1mol/L的氨水与0.1mol/L的盐酸溶液等体积混合:
c(NH3·H2O)+c(H+)=c(OH-)
D.0.1mol·L-1的NaHCO3溶液和0.1mol·L-1的NaOH溶液等体积混合:
c(Na+)==2c(CO2-3)+c(HCO-3)+c(H2CO3)
9.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol
Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH值(不考虑二氧化碳的溶解)。则电解过程中共转移电子的物质的量为 ( )
A.0.4mol B.0.5mol C.0.6mol D.0.8mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com