
1.2008年12月,卫生部印发首批非法食品添加剂名单。下列在食物中的添加剂(括号内物质)不属于非法食品添加剂的是
A.海参(甲醛) B.白酒(甲醇) C.奶粉(三聚氰胺) D.食盐(KIO3)
25.(9分)某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4· 5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2,反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480g,其中铜屑的质量分数为x,试回答下列。
(1)所得硫酸铜晶体的质量y为: g(H)x表示);
(2)若x=0.4,混酸中HNO3与H2SO4的物质的量之比为: ;
(3)若x=0.4,480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4·5H 20,试求原混酸中H2SO4的质量分数 。
24.(12分)已知某纯碱试样中含有NaCl杂质,为测定试样中的纯碱的质量分数,可用下图中的装置讲行实验。
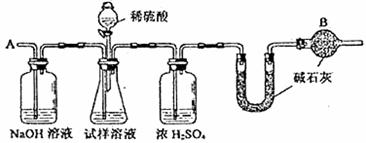
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性 ②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液 ③称量盛有碱石灰的U型管的质量,得到b g ④从分液漏斗滴入6 mol ·L-1的硫酸,直到不再产生气体为止 ⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到cg ⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为dg
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明
(2)装置中干燥管B的作用是
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填“偏高”、“偏低”或“不变”)
(4)步骤⑤的目的是 ;
(5)步骤⑦的目的是
(6)该试样中纯碱的质鼙分数的计算式为
23.(12分)用质量分数为36.5%的浓盐酸(密度为1.16 g/cm3)配制成1 mol/L的稀盐酸。现实验室仅需要这种盐酸220 mL。试回答下列问题:
(1)配制稀盐酸时,应选用容量为 mL的容量瓶;
(2)经计算需要 mL浓盐酸,在量取时宜选用下列量筒中的 。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸其温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形标线2-3 cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶
上述操作中,正确的顺序是(填序号) 。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是
(填“偏高”、“偏低”、“无影响”)。若未用蒸馏承洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是 (填“偏高”、“偏低”、“无影响”)。
22.(12分)现有A、B、C、D、E五种盐溶液,分别由K+、NH4+、Ag+、Ba2+、Al3+、
C1-、Br-、CO32-、SO42-、NO3-中的阳离子和阴离子各一种组成(五种盐所含阴、阳离子各不相同)。已知:①A+B→白↓,②A+D→白↓,⑧B+C→白↑+↓④D+C→白↓
⑤A溶液中[H+]=[OH-]⑥B溶液中[H+]=1×10-12 mol/L ⑦C、D、E三种溶液的pH<7,
根据以上实验事实可以推出(用分子式表示)A为 ;B为 ;C为 ;D为 ;E为 。写出③步反应的离子方程式: 。
21.(10分)A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1:2。在一定条件下,各物质之间的相互转化关系如下(图中部分产物未列出):请填写下列空白:
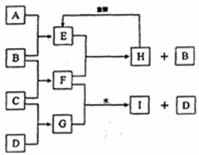
(1)A是 ,C是 。
(2)H与盐酸反应生成E的化学方程式是 。
(3)E与F反应的化学方程式是 。
(4)F与G的水溶液反应生成I和D的离子方程式是 。
20.把一定量的锌与100 mL,18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体Y 33.6L(在标准状况下)。将反应后的溶液稀释到l L,测得溶液的pH=1,则下列叙述正确的是 ( )
A.气体Y是SO2和H2的混合物 B.气体Y中SO2和H2的体积比为4:1
C.反应中共消耗锌87.5g D.反应中共转移电子3 mol
第Ⅱ卷(非选择题共55分)
19.下列叙述中正确的是 ( )
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2
C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出
18.有下列五个化学方程式(x、Y、Z均为正值):
①C2H2(g)+H2(g)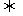 C2H4(g)
C2H4(g)
②CH4(g)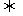 H2(g)+
H2(g)+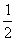 C2H4(g)
C2H4(g)
③C(s)+2H2(g)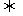 CH4(g);△H=
-X kJ·mol-1
CH4(g);△H=
-X kJ·mol-1
④C(s)+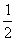 H2(g)
H2(g)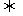
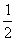 C2H2(g);△H=
-Y kJ·mol-1
C2H2(g);△H=
-Y kJ·mol-1
⑤C(s)+H2(g)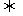
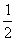 C2H4(g)△H=
-ZkJ·mol-1
C2H4(g)△H=
-ZkJ·mol-1
当温度下降时①式平衡向右移动,②式平衡向左移动。据此判定③-⑤式中关于X、Y、Z的大小顺序排列正确的是 ( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Z>X>Y
17.把氢氧化钙放入蒸馏水中,一定时间后达到如下平衡Ca(OH)2(s)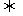 Ca2++2OH-加入以下物质,可使Ca(OH)2(s)减少的是 ( )
Ca2++2OH-加入以下物质,可使Ca(OH)2(s)减少的是 ( )
A.蒸馏水 B.A1C13溶液 C.NaOH溶液 D.CaCl2溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com