
21.(8分)在一个2L的密闭容器中,发生反应2SO3(g) 2SO2(g)+O2(g);△H>0,其中SO3的变化如下图所示:
2SO2(g)+O2(g);△H>0,其中SO3的变化如下图所示:
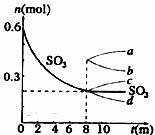
(1)写出该反应的平衡常数表达式_______________。
(2)用O2表示0-8min内该反应的平均速率V=_______________。
(3)升高温度,该反应的反应速率将_______________:K值将_______________;容器中气体的平均相对分子质量将_______________。(填“增大”“减小”或“不变”)
(4)能说明该反应已达到平衡状态的是_______________
a.v(SO3)=2v(O2) b.容器内压强保持不变
c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
(5)从8min起,压缩容器为1L,则SO3的变化曲线为________________________
A.a B.b C.c D.d
20.(8分)虽然氟元素早在1810年就被发现,但170多年米化学家试图用化学方法制取氟单质的尝试一直未获成功。直到l986年,化学家Karl Christe首次用化学方法制得了F2。他提出的三步反应如下(反应①、②里氟元素化合价不变):
①KMnO4+KF+H2O2+HF→K2MnF6+___________+H2O
②SbCl5+HF→SbF5+___________
③2K2MnF6+4SbF5==4KSbF6+2MnF3+F2↑
请根据以上反应回答问题:
(1)反应①中空格上应填物质的化学式为___________,为什么填这一物质,试用氧化还原反应理论解释____________________________________________;
(2)完成反应②____________________________________________。
(3)反应③中的氧化剂为___________,被氧化的元素为___________,若有lmol K2MnF6参加反应,将会有___________mol电子发生转移。
19.(12分)印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl2 1.5 mol·L-l、FeCl2 3.0 mol·L-1、FeCl3 1.0 mol·L -1、HCl 3.0 mol·L-1。取废腐蚀液200 mL按如下流程在实验室进行实验:
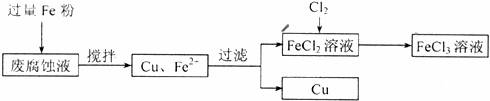
回答下列问题:
(1)在上述流程中,“过滤”用到的玻璃仪器:普通漏斗、玻璃棒、_________________;用上述方法获得的铜粉中含有杂质,除杂所需试剂是___________ (填化学式)。
(2)实验室可用浓盐酸和固体KMnO4直接反应制备Cl2。此反应的离子方程式为___________。此反应中体现了盐酸的___________性质。利用图1制备Cl2并通入到FeCl2溶液中获得FeCl3溶液。
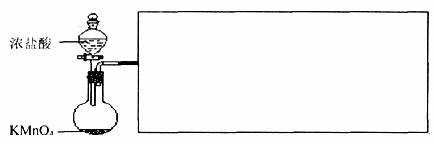
图1
请从图2中挑选所需的仪器,完成图l装置简图(可添加必要的塞子、玻璃导管、胶皮管。不画固定装置),并标明容器中所装试剂名称。
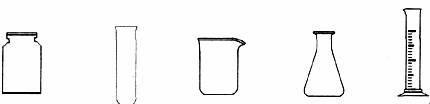
图2
(3)按上述流程操作,需称取Fe粉的质量应不少于___________g,需通入Cl2的物质的量不少于______________mol。
18.(10分)某课外兴趣小组为探究某种铝合金(合金元素为Mg AI)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图装置进行实验。
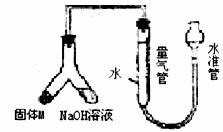
(1)如何检验该装置的气密性________________________________________________。
(2)合金样品固体M与氢氧化钠溶液反应的离子方程式______________________。
(3)倾斜左边装置使氢氧化钠溶液(足量)与ag 合金粉末(固体M)充分反应,待反应停止后,进入量气管气体的体积为VmL(已折算成标准状况)。若量气管最大量程为50mL,则固体M中锅的质量(mAl)范围为___________________。
(4)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积___________(填“>”“<”“=”)VmL。
(5)若a=38mg,V=44.8mL(标准:状况),请通过计算说明该合金是否符合国家标准(不写计算过程)____________ (填“符合”或“不符合”)。
17.27.2g铁粉和氧化铁的混合物,放入500mL稀H2SO4中,发现固体完全溶解,并放出4.48L H2(标况),加入NH4SCN溶液屙,无颜色变化,然后向溶液中加入2mol·L-l NaOH溶液,当溶液呈现中性时,用掉NaOH溶液500mL,则原硫酸溶液的物质的量浓度为
A.4mo1·L -l B.3mo1·L -l C.2 mol·L-l D.1 mol·L-l
第Ⅱ卷(非选择题 共6 0分)
16.硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,制取硝酸铜现有二种设计方案可供选用:
①Cu与稀硝酸反应制取:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
②Cu与浓硝酸反应制取:Cu+4HNO3=Cu(NO3)!+2NO2↑+2H2O
③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2=2Cu(NO3)2+2H2O
下列说法正确的是
A.制取相同量的硝酸铜需硝酸的量③最多
B.制取相同量的硝酸铜①产生的有毒气体比②多
C.三种方案中硝酸的利用率③>①>②
D.三种方案的反应都可以在铁制容器中进行
15.“信息”、“材料”和“能源”被称为新科技革命的三大支柱。下列有关资讯错误的是
A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B.目前中美日等国掌握的陶瓷发动机技术,大大提高了发动机的能量转化效率
C.2008年9月25日发射成功的“神舟七号”载人飞船使用了大量的复合材料
D.合成高分子材料的广泛应用是有百利而无一害
14.下图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是
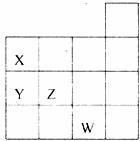
①X、Y的最高价氧化物的水化物酸性为Y<X
②Y、Z的气态氢化物的稳定性Y<Z
③W的单质常温下呈液态,一定条件下可与铁粉反应
④W的原子序数比Z大9
A.只有③ B.①② C.①②③ D.①②③④
13.下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Na+、MnO4一、SO42-
②pH=11的溶液中:CO32-、Na+、[Al(OH)4]一、NO3-
③加入Al能放出H2的溶液中:Cl一、HCO3一、SO42-、NH4+
④由水电离出的c(OH一)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl一、Br一
⑤有较多Fe3+的溶液中:Na+、NH4+、SCN一、HCO3一
⑥酸性溶液中:Fe2+、Al3+、NO3一、I一、Cl-
A.①② B.③⑥ C.②④ D.⑤⑥
12.NO2是导致光化学:烟雾的“罪魁祸首”之一。NO2可以用氢氧化钠溶液吸收,或在一定条件下用氨气(NH3)与其反应使之转化为无污染的物质,发生反应的化学方程式分别是:2NO2+2NaOH=M+NaNO3+H2O,8NH3+6NO2=7X+12H2O。则M和X代表的物质的化学式是
A.NaNO2、N2 B.HNO2、N2 C.NO、HNO3 D.Na3NO4、NO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com