
26.(15分)在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:2A(g)+B(g)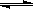 C(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD请填写下列空白:
C(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD请填写下列空白:
(1)从反应开始至达到平衡,用D表示的平均反应速率为______________________。
(2)B的平衡浓度为_________________ ,A的转化率为_______________________。
(3)在温度不变时,如果缩小容器体积,平衡体系中混合气体的密度_____________。(填“增大”、“减少”或“不变”)
(4)如果上述反应在相同条件下从逆反应开始进行,最初加1 mol C和2mol D,要使平衡时各物质的体积分数与原平衡相等,则还应加入_____________mol B物质。
13.吗丁啉是一种常见的胃药,其有效成分的结构简式可用下图表示。关于该物质的下列说法不正确的是 ( )

A.该物质的分子式为C22H25ClN5O2 B.该物质具有碱性,能与酸反应
C.该物质能发生水解反应 D.该物质能发生取代反应和加成反应
第Ⅱ卷(非选择题)
12.通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1价)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银):n(硝酸亚汞)=2:1,则下列表示正确的是: ( )
A.在两个阴极上得到的银和汞的物质的量之比n(银):n(汞) = 2 : 1
B.在两个阴极上得到的产物的物质的量不相等。
C.硝酸亚汞的分子式为HgNO3
D.硝酸亚汞的分子式为Hg2(NO3)2
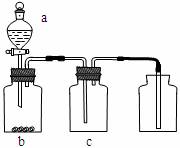
11.如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是 ( )
|
|
气体 |
a |
b |
c |
|
A |
NO2 |
浓硝酸 |
铜片 |
NaOH溶液 |
|
B |
SO2 |
浓硫酸 |
Cu |
酸性KMnO4溶液 |
|
C |
NH3 |
浓氨水 |
生石灰 |
碱石灰 |
|
D |
CO2 |
稀盐酸 |
CaCO3 |
浓硫酸 |
10.通常状况下,2molH2完全燃烧生成H2O(g)时放出484kJ热量,而生成H2O(l)时放出572kJ热量,则下列表达正确的是 ( )
A.H2的燃烧热:△H= -242 kJ·mol-1
B.2H2(g) + O2(g)=2H2O(g);△H= -242kJ·mol-1
C.H2O(g) =H2O (l);△H= +44 kJ·mol-1
D.H2O(l) =H2(g)+ 1/2O2(g);△H= +286kJ·mol-1
9.下列叙述正确的是 ( )
A.液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
B.若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数有可能为m+25
C.甲烷、白磷的分子都是正四面体结构,因此它们分子中化学键之间的夹角相同
D.阴离子的核外电子排布一定与上一周期稀有气体原子核外电子排布相同
8.某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的几种。现取该溶液进行实验,得到如下实验现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断,该溶液中肯定不存在的离子是 ( )
A.Al3+、Mg2+、I-、SO32- B.Mg2+、Na+、CO32-、I-
C.Al3+、Na+、SO32-、I- D.Al3+、CO32-、Br-、SO32-
7.对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:
11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4
下列关于该反应的说法正确的是 ( )
A.CuSO4发生了氧化反应
B.生成1 mol H3PO4时,有10 mol电子转移
C.氧化产物和还原产物的物质的量之比为6∶5
D.白磷只作还原剂
23.(12分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周测表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是____________。
(2)X与W组成的化合物中存在____________键(填“离子”“共价”)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为____________________________________。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式________________________。
②又知A既能与盐酸反应。又能与氯水反应,写出A与氯水反应的离子方程式________________________________________________。
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6rnol结晶水。对化合物B进行如下实验:
a取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色:
b另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
①B的化学式为________________________。
②已知1 mol·L-1100mL B的溶液能与1mol·L-120mLKMnO4溶液(硫酸酸化)恰好反应。写出反应的离子方程式_____________________________。
22.(10分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物。它们之间有如下转化关系:

(1)若甲是短周期金属单质,乙、丙是短周期非金属单质。X、Y、Z中只有一种是离子化合物,试推断:
①含有丙元素的化合物是____________(填X、Y、Z)
②X与甲反应的化学方程式____________________________________。
(2)若甲是具有氧化性的黄绿色气体单质,丙通常状况下是深红棕色液体,X、Y、Z含有同种元素形成的阳离子,但Y和Z的阳离子价态相同,X和Y的阳离子价态不同,试推断:
①写出乙、丙的化学式________________________。
②写出X与足量的甲在溶液中完全反应的离子方程式________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com