
8.广义的水解观认为,无论是盐的水解还是非盐的水解,其实质都是参与反应的物质和水分别离解成两部分,再重新组合成新的物质。由此,下列说法错误的是( )
A.NaClO的水解产物是HClO和NaOH
B.PCl3的水解产物是PH3和HCl
C.CaO2的水解产物是Ca(OH)2和H2O2
D.Mg3N2的水解产物是Mg(OH)2和NH3
7.室温下,pH相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
A.加水稀释2倍后,两溶液的pH均减小
B.使温度都升高20℃后,两溶液的pH均不变
C.加适量的醋酸钠晶体后,两溶液的pH均减小
D.加足量的锌充分反应后,醋酸产生的氢气比盐酸多
25.(5分)某研究性学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物a g,可全溶于200 mL 5 mol/LHCl溶液中,共收集到标准状况下的氢气3.36 L。
(1)a的取值范围是 。
(2)向反应后所得溶液中逐渐加入4 mol/L的NaOH溶液。当沉淀质量达到最大值时,加入的NaOH溶液的体积是 mL。
(3)计算混合物中镁与盐酸反应时,有多少摩尔电子转移(可用含a的代数式表示)
24.(21分)图(Ⅰ)中瓶a内放入20 mL 6mol/L盐酸,b是未充气的气球,里边放有4 g碳酸钙粉末,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气)。将图(Ⅰ)的装置在托盘天平上称量,质量为W1 g。根据实验现象填空:
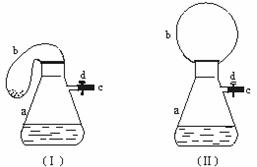
(1)把气球b中的碳酸钙粉末小心地倒入瓶中,立即产生许多气泡,气球逐渐胀大(图Ⅱ)。反应结束后,再次称量,质量为W2 g。则W2和W1的关系是_______________。
(2)配置95 mL 6.00mol/L NaOH溶液,需要NaOH固体 克。
要用到的玻璃仪器有 。
在操作中,玻璃棒有什么作用 。
在操作中出现下列情况会导致所配置的溶液浓度偏低 不变 (都填序号)
①氢氧化钠敞口放置 ②称量左物右码 ③转移有液体溅出
④读数时仰视 ⑤ 没有烘干锥形瓶 ⑥没有用蒸馏水洗烧杯
(3)取25 mL 6mol/L NaOH溶液,先用滴管取少量NaOH溶液,滴管插入胶管c口(为便于操作,可以适当倾斜瓶a,注意防止漏气。打开d,将溶液挤入瓶中,立即夹紧d。可以看到瓶内产生少量白色沉淀,轻轻摇动瓶a,沉淀随即消失。用同样方法再加入少量NaOH 溶液,又产生白色沉淀,轻摇,沉淀又消失。(提示:滴加溶液时会出现局部溶液过浓) 使沉淀产生又消失的离子方程式是 ,
(4)将全部NaOH溶液很快加入瓶中,夹紧d,瓶内产生大量白色沉淀,不再溶解。继续轻摇瓶a,气球逐渐缩小,直至恢复反应前的下垂状。写出这时发生的反应的化学方程式
(5)计算标况下气球内最多能产生的气体的体积。要求格式规范
23.(7分)有一种工业废水,已知其中含有大量硫酸亚铁,少量Ag+和Na+。今设计一种既经济又合理的方法,回收银和硫酸亚铁。设计方案如下图所示
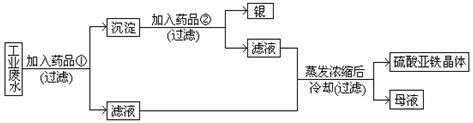
(1)药品①是
(2)沉淀是
(3)药品②是 (填写化学式)
(4)母液中存在的阳离子
(5)加入药品②后所溶液中发生的反应的离子方程式
22.(11分)已知有一白色粉末是由NaCl、Na2SO4、Na2CO3、CuSO4、MgCl2中的一种或几种组成。某同学欲探究这一粉末的组成,做了如下实验:
①取少量粉末,加水溶解,得无色透明溶液;
②取①中溶液少量,加入NaOH溶液,无明显现象发生;
(1)请你根据该同学实验所得现象,推测这一粉末的可能组成有几种,填数字
(2)若某同学设计实验最终测定该粉末只由NaCl、Na2SO4 Na2CO3、组成,请你认为他还要作哪些实验才能确定。可选择的试剂有BaCl2溶液、AgNO3溶液、稀HNO3、NaOH溶液、Na2CO3溶液、Ba(NO3)2溶液、稀盐酸
|
实验步骤 |
实验现象 |
反应离子方程式和结论 |
|
|
|
|
|
|
|
|
|
|
|
|
注:实验步骤的序号由你顺序编号。实验现象、离子方程式和结论要与相应的实验步骤对应。
21.(16分)在下列物质中:①澄清石灰水 ②盐酸 ③CaO ④Cu(OH)2 ⑤AgCl
⑥Na2CO3 ⑦C2H5OH ⑧H2O ⑨CO2 ⑩Fe
(1)属于电解质的是___________ ;(填写序号)
(2)属于非电解质的是 ____________;(填写序号)
(3)能与②反应的有几类物质,填写下表
|
类别 |
金属单质 |
|
|
|
|
所属物质 |
|
⑥ |
|
|
(4)写出少量的⑨通入①反应的离子方程式__________________;
②和④反应的离子方程式_________________;⑥的电离方程式_________________。
(5)写出③和⑧反应的化学方程式 。
20.将标准状况下的a升氯化氢气体溶于1升水中,得到的盐酸的密度为b克/毫升,则该盐酸的物质的量的浓度是( )
A.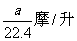 B.
B.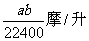
C.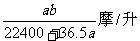 D.
D.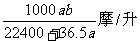
第Ⅱ卷 (共60分)
19.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
①28 g氮气所含有的原子数目为NA
②4 g金属钙变成钙离子时失去的电子数目为0.1 NA
③在常温常压下,11.2 L N2含有的分子数为0.5 NA
④在标况下,1 mol Ne含有的原子数为NA
⑤0.5 mol单质铝与足量盐酸反应转移电子数为1.5NA
⑥标准状况下,1 L水所含分子数为1/22.4NA
⑦17 g氨气所含电子数目为10NA
A.①②⑤⑥⑦ B.①②④⑤⑥ C.⑤⑦ D.④⑤⑦
18.人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常放入抗氧化物质。下列不属于抗氧化物质的是
A.生石灰 B.还原铁粉 C.亚硫酸钠 D.维生素C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com