
2.下列说法正确的是 ( )
A.宏观上的物质对外不显电性,是因为组成它们的微观粒子都是电中性的原子和分子
B.某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物
C.利用化学方法,我们可以制造出新的分子,但不能制造出新原子
D.由两种元素组成的电解质分子中,显正价的是阳离子,显负价的是阴离子
1.关于化工生产的下列叙述中,不正确的是 ( )
A.工业生产硫酸时,使用热交换器可以充分利用反应热
B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的
C.电镀精炼铜时,纯铜与直流电源的负极相连
D.工业上金属Mg、Al都是用电解熔融的氯化物制得的
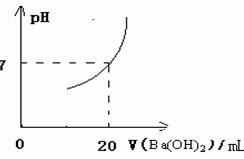
28.在20mL由HNO3和H2SO4组成的混合溶液中,逐滴加入4mol/L Ba(OH)2溶液,结果如下图所示,求原溶液中HNO3和H2SO4的物质的量浓度分别是多少?
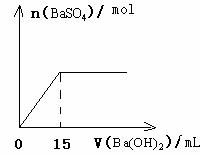
27.某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定。回答下列问题:
⑴甲同学运用沉淀法测定样品中NaOH的含量。甲同学选用的药品除样品外,还应有 ;实验中应测定的数据有 。
⑵乙同学运用滴定法测定样品中NaOH的含量。
①用分析天平准确称取该样品5.00g,全部溶于水配制成1000.0mL的溶液。用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴指示剂,待测。滴定管在使用前除洗涤外,还应 。
②用浓度为0.1000mol/L的盐酸标准溶液进行滴定。开始滴定前的一步操作是 。
③滴定过程中用 测定锥形瓶中溶液的pH,临近滴定终点时测定pH应 。
④滴定过程中,锥形瓶中溶液的pH变化如下
|
V(HCl)/mL |
0.00 |
12.00 |
18.00 |
22.00 |
23.00 |
23.96 |
24.00 |
24.04 |
25.00 |
26.00 |
30.00 |
|
pH |
13.1 |
12.6 |
12.2 |
11.7 |
11.4 |
9.9 |
7.0 |
4.0 |
2.7 |
2.4 |
1.9 |
请在答题卡上的坐标图中绘制出上述中和滴定的曲线。
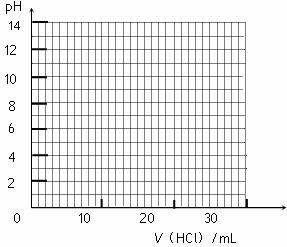
⑤ 下表是几种酸碱指示剂的变色范围,根据你作出的中和滴定曲线分析,上述中和滴定中应选用的指示剂是 。
|
指示剂 |
变色范围 () |
颜色 |
|
|
酸色 |
碱色 |
||
|
甲基橙 |
3.1-4.4 |
红 |
黄 |
|
石蕊 |
5.0-8.0 |
红 |
蓝 |
|
酚酞 |
8.2-10.0 |
无 |
红 |
⑥样品中,NaOH的质量百分含量为 。
26.[1]25℃时硫氢化钾溶液里存在下列平衡:(a)HS- +
H2O OH- +H2S
OH- +H2S
(b)HS-  H+ + S2-
H+ + S2-
(1) 是电离平衡; 是水解平衡
(2)当向其中加入硫酸铜溶液时,生成了CuS沉淀,则电离平衡向 移动;水解平衡向 移动;c(H+)变(填”大”或”小”)
(3)当向其中加入氢氧化钠固体时,c(S2-)变(填大或小)
(4)若将溶液加热到沸腾,c(OH-)·c(H+)将(填大或小)
[2](6分)NaHA和NaHB两种酸式盐的溶液分别加水稀释时,pH值的变化如下图所示。
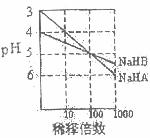
(1)H2A是___ _____酸(填“强”或“弱”)。
(2)0.1 mol/L的NaHB溶液与0.1 mol/L NaOH溶液等体积混合后溶液的pH____ _7,原因是(用离子方程式表示) _______
13.某温度下,0.1 mol/L醋酸溶液的pH=3。将该温度下0.2 mol/L醋酸溶液和0.2mol/L醋酸钠溶液等体积混合后,混合液的pH=4.7。下列说法正确的是( )
A.该温度下,0.0l mol/L醋酸溶液的pH=4
B.该温度下,用0.1 mol/L醋酸和0.01 mol/L醋酸分别完全中和等体积0.1 mol/L的NaOH溶液,消耗两醋酸的体积比为1∶10
C.该温度下,0.2 mol/L醋酸溶液和0.4 mol/L醋酸钠溶液等体积混合后混合液的pH<4.7
D.该温度下,0.2 mol/L醋酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH=4.7
第II卷(非选择题)
12.下列说法正确的是( )
①用25mL酸式滴定管可以准确放出8.00mL的稀盐酸;
②可用干燥的pH试纸测定氯水的pH;
③使用容量瓶配制溶液,定容时俯视,所得溶液的浓度偏大;
④加入盐酸有能使澄清石灰水变浑浊的无色气体生成,则原溶液中一定有大量CO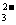 存在;
存在;
⑤在某温度下,一定量的醋酸与氢氧化钠溶液充分混合,若溶液呈碱性时,溶液中离子浓度大小的关系一定为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
⑥下图是反应物和生成物的能量变化示意图,其可能发生反应的热化方程式可表示为:
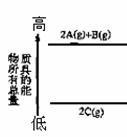
2A(g)+B(g) 2C(g); △H=QkJ·mol-1(Q<0)。
2C(g); △H=QkJ·mol-1(Q<0)。
A.①③⑤ B.②④⑤ C.①③⑥ D.③⑤⑥
11.在100毫升某一元弱酸(Ka=10-3-10-7)的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如下图所示,下列叙述正确的是:( )
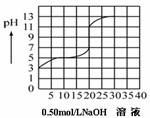
A.该弱酸在滴定前的浓度是0.15 mol/L:
B.该弱酸的电离常数(Ka)是10-5
C.当实验到达滴定终点时,溶液的PH值恰好为7
D.在滴定过程,为求滴定终点,最合适的指示剂是甲基橙
10.经测定某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),其可能的情况是( )
A.该溶液可能由0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合而成
B.该溶液可以由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成
C.该溶液中离子浓度的关系符合c(CH3COO-)+c(OH-)>c(Na+)+c(H+)
D.在上述溶液中加入适量NaOH,离子浓度大小可改变为 c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
9.常温下,下列各组离子在指定环境下能大量共存的是( )
A.pH=l的溶液中:Na+、K+、SO32-、MnO4-
B.pH=7的溶液中:Na+、A13+、SO32--、SO42-
C.pH>12的溶液中:Na+、K+、SO32-、AlO2-
D.pH=0的溶液中:Na+、K+、NO3-、ClO-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com