

4.若NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.7. 1g Cl2 与足量NaOH溶液反应转移电子数为0.2 NA
B.在25˚C,101KPa时,14 g氮气中含有7 NA个电子
C.在0˚C,101KPa时,含有 NA个氢原子的氢气体积为22 .4 L
D.标准状况下11.2 LSO3所含的分子数为0 .5 NA
3.下图是元素周期表的一部分,下列说法中正确的是 ( )
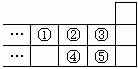
A.元素①位于第二周期第ⅣA族
B.气态氢化物的稳定性:④>②
C.最高价氧化物对应水化物酸性:⑤>④
D.元素的最高正化合价:③=⑤
2.下列表述不正确的是 ( )
A.人造刚玉熔点很高,可用作高级耐火材料,主要成分是Al2O3
B.在医疗上碳酸氢钠可用于治疗胃酸过多
C.用于现代通讯的光导纤维的主要成分是高纯度的硅
D.分散系中分散质粒子的直径:Fe(OH)3 悬浊液>Fe(OH)3 胶体>FeCl3 溶液
1.氢化锂、氘化锂、氚化锂在一定条件下都可产生极高的能量,被广泛应用在火箭推进剂和核反应中。下列说法正确的是 ( )
A.LiH、LiD、LiT的摩尔质量之比为1:2:3
B.它们都是强氧化剂
C.H、D、T之间互称为同素异形体
D.它们都是强还原剂
2.每小题选出答案后,用铅笔把答题卡上对应题目标号涂黑,如需改动用橡皮擦干净
后,再选涂其它答案标号,不能答在试题卷上。
本卷共14小题,每题3分,共42分。在下列各题的四个选项中,只有一个选项是符合题目要求的。
可能用到的相对原子质量:H 1 Li 7 N 14 O 16 Na 23 Al 27 Cl 35.5 K 39 Fe 56
29.Ⅰ(22分)已知A、B、C、D、E、F、G、H 可以发生如下图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。
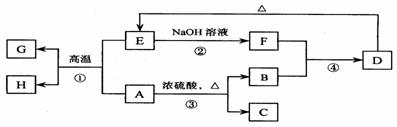
请填空:
(1)H的名称是 。
(2)E的两种用途是 、 。
(3)反应③的化学方程式是 。
(4)反应④的离子方程式是 。
Ⅱ.(13分)物质间的转化关系如下图所示:
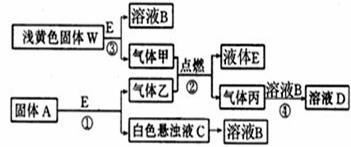
(1)写出反应③的离子方程式 ,生成标准状况下5.6 L气体甲,则转移电子的物质的量为 mol。
(2)固体A是一种重要的工业原料。1 mol气体乙完全燃烧时生成l mol E和2 mol丙。则乙的电子式为 ,其分子空间构型是 。
(3)C溶液中的溶质和丙以物质的量之比1:2反应时.该反应的离子方程式为 。若甲和乙恰好完全反应.则A与W的物质的量之比为 。
28.(19分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
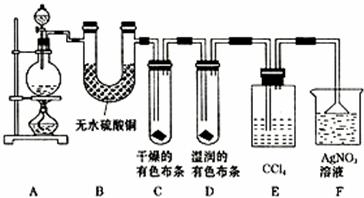
(1)下列方法中,可制得氯气的正确组合是( )。
(已知酸性条件下,K2Cr2O7、、KClO3的氧化性均强于Cl2;酒精灯可以不用)
①MnO2 和浓盐酸混合共热; ②次氯酸钠和浓盐酸混合 ;
③K2Cr2O7 和浓盐酸混合; ④KClO3 和浓盐酸混合共热;
⑤KMnO4和浓盐酸混合;
A.只有① B.只有①⑤ C.只有①③④⑤ D.全部可以
(2)若用含有0.2 mol HCl 的浓盐酸与足量的 MnO2 反应制 Cl2, 制得的 Cl2 体积 (标准状况下 )总是小于1.12 L的原因是 。
(3)①装置B的作用 , 现象是 。
②装置C和D出现的不同现象说明的问题是 。
③装置E的作用是 。
④写出装置F中发生反应的离子方程式 。
(4)乙同学认为甲同学的实验有缺陷 , 不能确保最终通入 AgNO3 溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入 AgNO3 溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在 之间(填装置字母序号),装置中应放入 。
27.(9分)A、B、C、D、E、F是六种短周期的主族元素,它们的原子序数依次递增;A元素与其它元素不在同一周期,C元素与B、D元素同周期相邻;C元素的最高价氧化物对应水化物与C元素的气态氢化物能反应生成盐;D、F元素同族,E是短周期主族中原子半径最大的元素。
请完成下列问题:
(1)E原子的结构示意图为____________,C元素的气态氢化物的空间构型为_________;
(2)BF2的电子式为_______________________;
(3)已知气体BA4的燃烧热为890.3KJ/mol,试写出表示BA4燃烧热的热化学方程式:______________________________________;
26.(10分)(1)有三种盐的混合液,其中含有Na+、SO42-、Mg2+和Cl-。其物质的量分别为Na+0.2mol、Mg2+0.25mol、Cl-0.4mol、则SO42-物质的量为 mol.
(2)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
①冶炼铜的反应为8CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
②上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
③过二硫酸钾(K2S2O8)具有强氧化性可将I-氧化为I2:S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+ 均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。 、 。(不必配平)
13.在Fe与Cu的混合物中加入一定量的稀HNO3,充分反应后剩余金属m1克,再向其中加入一定量的稀H2SO4,充分振荡后,剩余金属m2克,则m1与m2的关系是 ( )
A.m1一定大于m2 B.m1可能等于m2
C.m1一定等于m2 D.m1可能大于m2
第II卷(非选择题)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com