
14.有一块铝铁合金,将其溶解于足量盐酸中,再加入过量NaOH溶液,在空气中静置至红褐色沉淀不再增加时,将沉淀滤出再灼烧至恒重,得到残留物的质量与原合金质量相同,则合金中铝的质量分数是 ( )
A.22.2% B.30% C.75.5% D.80.6%
第Ⅱ卷(非选择题 共58分)
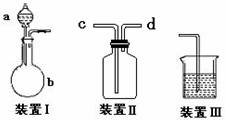
(1)甲同学认为利用该装置可制取和收集NH3、H2,但不能收集CO2,其理由是:______,制取NH3 时,装置Ⅰ的a中的试剂为 ;
(2)乙同学认为装置Ⅰ可作为实验室制氧气的快速发生器,对装置Ⅱ稍作改进后即可作为O2 的收集装置,乙同学对装置Ⅱ的最佳改进方法是:______________________,制O2 时在装置Ⅰ中反应的化学方程式为__________________;
(3)丙同学也将装置Ⅱ改进并用上图整套装置制取、收集SO2 并验证其还原性,则装置 Ⅰ的b中的试剂为 ,验证SO2 的还原性并除去过量SO2 的装置和试剂分别是 、 。
13.如图,B为常见金属或非金属单质,有下列转化关系:
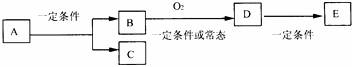
若C是可用作自来水消毒的气体,D、E都是二元化合物(由两种元素组成),D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是 ( )
A.NaCl B.H2O2 C.KCl D.AlCl3
12.把SO2 通入Fe(NO3)3 溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,这时若 滴入BaCl2 溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是( )
A.SO2 B.Cl- C.Fe3+ D.NO3 –
11.下列说法中,正确的是 ( )
A.所有主族元素正化合价数等于它的族序数
B.VII A族元素的原子随核电荷数的增加,得电子能力逐渐减弱
C.IA、IIA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
D.前三周期元素中共有非金属元素12种
10.对下列各种溶液中所含离子的判断合理的是 ( )
A.在pH=13的溶液中可能含:Na+,AlO2-,CO32-,SO32-
B.向无色溶液中加氯水变橙色,溶液中可能含:SO42-,Br-,OH-,Ba2+
C.在常温下加入铝粉有氢气放出,则溶液中可能含:K+,Na+,H+,NO3-
D.使紫色石蕊试液变红色的溶液中可能含:K+,Na+,Ca2+,HCO3-
9.下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此,下列说法正确的是 ( )

A.该硫酸的物质的量浓度为9.2 mol·L-1
B.配制100mL 4.6 mol·L-1 的稀硫酸需取该硫酸25 mL
C.配制100mL4.6 mol·L-1 的稀硫酸操作的正确顺序为:量取、稀释、移液、冷却、定容
D.该硫酸与等体积的水混合后所得溶液的物质的量浓度等于9.2 mol·L-1
8.下列反应的离子方程式正确的是 ( )
A.钠投入水中:Na + H2O = Na+ + OH- + H2↑
B.硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+ = BaSO4↓
C.碳酸钙溶于醋酸:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
D.硫酸亚铁溶液(酸性)中加入过氧化氢: 4Fe2++ 2H2O2 + 4H+ = 4Fe3+ + 4H2O
7.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液。由于浓度不同而能发生不同氧化还原反应的是 ( )
A.①③ B.③④ C.①② D.①③④
6.下表为各物质中所含有的少量杂质,以及除去这些杂质应选用的试剂或操作方法。正确的一组为 ( )
A.①②③④ B.③④ C.②③④ D.①②③
|
序号 |
物质 |
杂质 |
除杂质应选用的试剂或操作方法 |
|
① |
KNO3溶液 |
KOH |
加入FeCl3溶液,并过滤 |
|
② |
FeSO4溶液 |
CuSO4 |
加入过量铁粉,并过滤 |
|
③ |
H2 |
CO2 |
通过盛有NaOH溶液的洗气瓶,再通过盛有浓硫酸 的洗气瓶 |
|
④ |
NaNO3粉末 |
CaCO3 |
溶解、过滤、蒸发浓缩、降温析晶、过滤 |
5.物质的鉴别有多种方法,下列能达到鉴别目的的是 ( )
①用水鉴别汽油、乙醇、苯
②用相互滴加的方法鉴别Na2CO3 和硫酸溶液
③用加热的方法鉴别NH4Cl和NaHCO3 固体
A.①② B.②③ C.①③ D.①②③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com