

17.(3分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列两个热化学反应方程式:
FeO(s)+CO(g)= Fe(s)+ CO2(g) △H= ―218kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原Fe3O4固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
16.(4分)为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg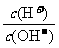 。
。
(1)中性溶液的AG=
(2)常温下0.01mol·L-1盐酸溶液的AG=
15.500℃、20 MPa时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中 H2、N2和NH3物质的量变化如图所示。则下列说法正确的是: ( )
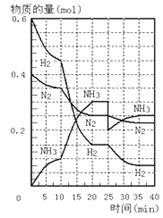
①反应开始到第一次平衡时,N2的平均反应速率为0.005mol·L-1·min-1
②从曲线变化可以看出,反应进行到10 min至20 min钟时可能是使用了催化剂
③从曲线变化可以看出,反应进行至25min钟时,分离出0.1mol的氨气
④在25min时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小
A.①② B.①③ C.②③ D.②④
第II卷 非选择题(共40分)
14.已知AgI为黄色沉淀,AgCl为白色沉淀。25℃时, AgI饱和溶液中c(Ag+)为1.22×10-8
mol·L-1,AgCl饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5mL含有KCl和KI浓度均为0.01mol·L-1的混合溶液中,滴加8mL 0.01mol·L-1的AgNO3溶液,则下列叙述中不正确的是 ( )
A.溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
B.溶液中先产生的是AgI沉淀
C.AgCl的KSP的数值为1.69×10-10
D.若在AgI悬浊液中滴加少量的KCl溶液,黄色沉淀不会转变成白色沉淀
13.关于下列四个图像的说法中正确的是 ( )
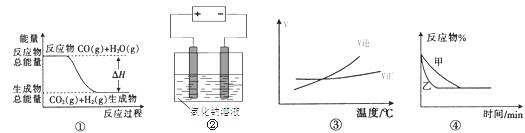
A.图①表示可逆反应“CO(g)+ H2O(g) CO2(g)+H2(g)”中的ΔH大于0
CO2(g)+H2(g)”中的ΔH大于0
B.图②是在电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1:1
C.图③表示可逆反应“A2(g)+3B2(g) 2AB3(g)”的ΔH小于0
2AB3(g)”的ΔH小于0
D.图④表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
12.下图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.2 mol电子通过,若忽略溶液体积变化,下列叙述正确的是 ( )
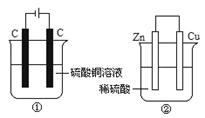
A.产生气体体积:①=②
B.①中阴极质量增加,②中正极质量减小
C.电极反应式:①中阳极:4OH-→ 2H2O+O2↑- 4e- ②中负极:2H++2e-→H2↑
D.溶液的pH变化:①减小,②增大
11.在25℃下,将a mol·L-1的醋酸(HAc)与0.01 mol·L-1的氢氧化钠溶液等体积混合,反应平衡时溶液中c(Na*)=c(Ac-)。则下列说法中,不正确的是 ( )
A.此时醋酸和氢氧化钠溶液恰好中和
B.反应平衡时溶液显中性
C.用含a的代数式表示醋酸(HAc)的电离常数为Ka= mol·L-1
D.a肯定大于0.01
10.取0.2 mol·L-1 HX溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是 ( )
A.混合溶液中由水电离出的c(OH-)小于0. mol·L-1 HX溶液中由水电离出的
c(H+)
B.c(Na+)=c(X-) +c(HX)=0.2 mol·L-1
C.c(Na+)-c(X-)=9.9×10-7 mol·L-1
D.c(OH-)=c(HX)+c(H+)=1×10-8 mol·L-1
9.在密闭容器中,反应X2(g)+Y2(g) 2XY(g);ΔH<0,达到甲平衡。下面的三个图形表示了在仅改变某一条件后,达到乙平衡的情况,对此过程的分析正确的是(
)
2XY(g);ΔH<0,达到甲平衡。下面的三个图形表示了在仅改变某一条件后,达到乙平衡的情况,对此过程的分析正确的是(
)
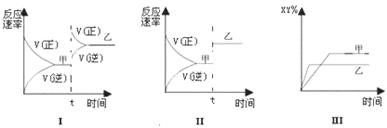
A. 图Ⅰ是加入适当催化剂的变化情况 B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况 D.图Ⅲ是升高温度的变化情况
8.一定条件下,体积为5L的密闭容器中,0.molX和0.molY进行反应:2X(g)+Y(g)
 Z(g),经60s达到平衡,生成0.5molZ。下列说法正确的是 ( )
Z(g),经60s达到平衡,生成0.5molZ。下列说法正确的是 ( )
A.将容器体积变为10L,Z的平衡浓度变为原来的一半
B.以Y浓度变化表示的反应速率为0.0005mol·L-1·s-1
C.若增大压强,则物质Y的转化率减小
D.若降低温度,X的体积分数增大,则该反应的 H<0
H<0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com