
3.国际互联网上报道“目前全世界上有30亿人患有缺铁性贫血”这里的铁指的是( )
A.铁单质 B.铁元素 C.氧化铁 D.四氧化三铁
2.潮湿的氯气、新制备的氯水、漂白粉的酸性溶液均能使有色布条退色,是因为它们都含有( )
A.氯气 B.次氯酸 C.次氯酸根离子 D.盐酸
1.关于假说,有下列表述,其中正确的是( )
A.假说是对现实中已知事实或现象的一种简单化处理
B.假说是对未知领域的事物或现象提出的一种推测
C.假说是对一个问题的幻想或假定
D.假说最终都可以变为科学理论
34.[化学-物质结构与性质]
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第IB族。Cu2+的核外电子排列式为__________________。
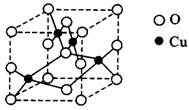
(2)图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为______。
(3)胆矾CuSO4·5H2O可成[Cu(H2O4)]SO4·H2O,其结构示意图如下:
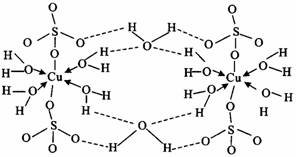
下列说法不正确的是________(填字母)
A.在上述结构示意图中,硫原子采用sp3杂化;
B.在上述结构示意图中,存在配位键、共价键和离子键;
C.胆矾是分子晶体,分子间存在氢键;
D.胆矾中的水在不同温度下会分步失去。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)]2+配离子,已知NF3与NH3的空间构型是三角锥形,但NF3不易与Cu2+形成配离子,其原因是______________________。
(5)Cu2O的熔点比Cu2S的________(填“高”或“低”),请解释原因____________。
33.[化学-有机化学基础]
A-J均为有机化合物,它们之间的转化如下图所示:
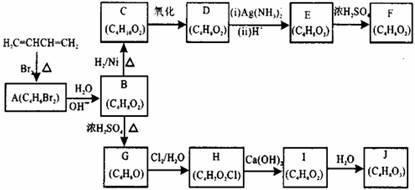
实验表明:
①D既能发生银镜反应,又能与金属钠反应放氢气;
②核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1;
③G能使溴的四氯化碳溶液褪色;
④1mol J与足量金属钠反应可放出22.4L氢气(标准状况)。
请根据以上信息回答下列问题:
(1)A的结构简式为_______________(不考虑立体异构),由A生成B的反应类型是__________反应;
(2)D的结构简式为___________;
(3)由E生成F的化学方程式为________________,E中的官能团有___________(填名称),与E具有相同官能团的E的同分异构体还有__________________(写出结构简式,不考虑立体异构);
(4)G的结构简式为_____________;
(5)由I生成J的化学方程式为____________________________________。
27.(14分)下表列出了部分常见的含有10电子和18电子的粒子,试回答下列问题:
|
10电子粒子 |
CH4、NH3、H2O、HF、Na+、Al3+、NH4+、F- |
|
18电子粒子 |
H2S、HCl、K+、S2-、HS-、Cl- |
(1)其中空间构型为四面体的分子是_____________;受热最难分解的分子是_________。
(2)其中能与OH-反应的分子有________________;既能与H+反应又能与OH-反应的粒子有_______________。
(3)其中在水溶液中能够促进水电离的粒子有__________________________;由表中粒子形成的某些离子化合物的水溶液呈酸性,试写出其中一个离子方程式______________。
(4)由第二周期元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可作火箭发动机的燃料,B是一种常见强氧化剂。已知16g 液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838kJ热量。写出A与B反应的热化学方程式:________________________________________。
选考题(每科选做1题)
26.(14分)有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可两两组成甲、乙、丙、丁四种化合物,各化合物中原子个数之比如下表:
|
|
甲 |
乙 |
丙 |
丁 |
|
化合物中各元素原子个数之比 |
A:C=1:1 |
B:A=1:2 |
D:E=1:3 |
B:E=1:4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;在元素周期表中,C是E的邻族元素,化学性质活泼;D和E位于同一周期,且D和E的原子序数之和为30。
(1)D和E同属第____________周期元素,推断依据是____________________________。
(2)根据题目提供的条件,推断E在周期表中的族序数:__________________________。
(3)向甲的水溶液中加入MnO2,反应的化学方程式为_____________________________。
(4)已知乙的相对分子质量小于甲。在实验室常用什么方法制得乙?________________。(用化学方程式表示)
(5)向30mL 1mol·L-1 的KI溶液中依次注入下列试剂:①1mL 5mol·L-1盐酸②0.5mL30%的甲溶液③1mL丁。经充分振荡后,可得紫色溶液。这种紫色溶液是_________。
25.(15分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
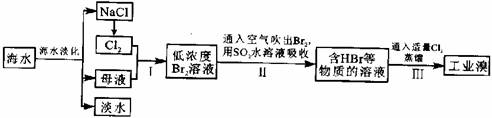
(1)请列举海水淡化的两种方法:____________、____________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、______或H2、_________。
(3)步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为__________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_________________________,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是___________________
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:

请你参与分析讨论:
①图中仪器B的名称:___________________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为________________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:________。
④C中液体产物颜色为___________________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________________________。
13.将15mL 2mol·L-1 Na2CO3溶液逐滴加入到40mL 0.5mol·L-1 MCln盐溶液中,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,则MCln中n值是
A.4 B.3 C.2 D.1
第Ⅱ卷
必考题
12.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com