
5.用NA表示阿伏加德罗常数的值。下列叙述正确的是 ( )
A.7.8gNa2O2含有的阴离子数目为0.2NA
B.标准状况下,22.4L水中共价键数目为2NA
C.近年来,科学家们发现由100个碳原子构成具有完美对称性的C100分子,则一个C100分子的质量为1200/NAg
D.5.6g Fe与足量的氯气反应时失去的电子数目为0.2NA
4.某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断 ( )
A.R一定是第四周期元素
B.R一定是IVA族元素
C.R的气态氢化物比同周期其他元素气态氢化物稳定
D.R气态氢化物化学式为H2R
3.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液由于浓度不同而能发生不同氧化还原反应的是 ( )
A.①③ B.③④ C.①② D.①③④
2.分类是学习和研究化学的一种常用的科学方法。下列分类合理的是 ( )
①根据酸分子中含有H原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤根据反应的热效应将化学反应分为放热反应和吸热反应
A.②③ B.②⑤ C.①②④ D.②③④⑤
1.下列说法正确的是 ( )
A.需加热才能进行的反应一定是吸热反应
B.碳酸氢钠可用于治疗胃酸过多,碘盐中的碘可以直接用淀粉检验
C.Fe(OH)3胶体和MgCl2溶液共同具备的性质之一是分散质微粒可通过滤纸
D.含有金属元素的离子一定都是阳离子;只含有非金属元素的离子一定是阴离子
29.(14分) 化合物A、B的相对分子质量均为86,C、H、O的原子个数之比为2∶3∶1。各物质之间的转化关系如下:

A、B、C均能使Br2的CCl4 溶液褪色,F可以发生银镜反应,E既不能发生银镜反应也不能使Br2的CCl4 溶液褪色。
提示:羟基直接连在碳碳双键上的结构(烯醇结构)不稳定,会发生如下重排:
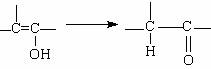
请回答下列问题:
(1)A的分子式是 。
(2)A
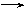
 C
+ D 属于 反应(写反应类型)。
C
+ D 属于 反应(写反应类型)。
(3)推出A、B、F结构简式 、 、 。
(4)写出D
+ E 
 G的化学反应方程式
。
G的化学反应方程式
。
(5)写出满足下列条件的A的所有同分异构体(B不必再写):
①是链状化合物 ②分子内含有 的基团
的基团
(6)写出A的聚合反应方程式 。
28.(15分)以下是分析硫铁矿中FeS2含量的三种方法,各方法的操作流程图如下:
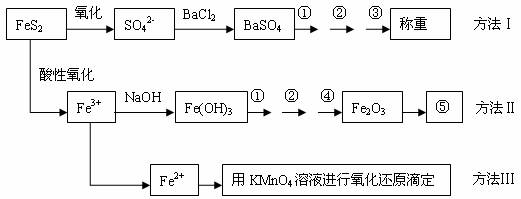
请回答下列问题:
(1)流程图中操作①、②、③分别指的是:①___________、②__________、③________。 操作④、⑤用到的主要仪器是:④_____________、⑤_____________(每空填1-2个仪器)。
(2)判断溶液中SO42-离子已沉淀完全的方法是 。
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,准确称取一定量的矿石试样,试样经溶解、预处理后,(A)用带有刻度的烧杯配制成100 mL试样溶液。(B)用量筒量取25.00 mL待测溶液,(C)并置于锥形瓶中。(D)用蒸馏水洗涤滴定管后装入KMnO4标准溶液,用该标准溶液滴定待测试样,(E)当溶液变成淡紫红色时,停止滴定,如30秒内不褪色,(F)读取并计算滴定管中消耗的KMnO4标准溶液体积,计算试样中的Fe元素含量。
请指出该实验过程中错误操作步骤的编号:_______________________________。
(4)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是____________________________ 。
(5)称取矿石试样1.60 g, 按方法Ⅰ分析,称得BaSO4的质量为4.66 g,假设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是________。
27.(15分)碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:
W(s)+
I2(g)  WI2(g)
WI2(g)
为模拟上述反应,在实验室中准确称取0.508 g碘、0.736 g金属钨放置于50.0 mL密闭容器中,并加热使其反应。下图是混合气体中的WI2蒸气的物质的量随时间变化关系的图像[n(WI2) - t],其中曲线Ⅰ(0-t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。

请回答下列问题:
(1)该反应是 (填写“放热”、“吸热”)反应。
(2)反应从开始到t1(t1= 3 min)时间内的平均速率v(I2)= 。
(3)在450℃时,该反应的平衡常数K= 。
(4)能够说明上述反应已经达到平衡状态的有 。
A.I2与WI2的浓度相等
B.单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等
C.容器内混合气体的密度不再增加
D.容器内气体压强不变化
(5)假设灯丝温度为660℃,灯泡壁温度为350℃。请根据化学反应原理分析在灯泡内充入碘能够延长钨丝寿命的原因 。
26.(14分) A~L是由6种短周期元素组成的物质,各物质之间有如下转化关系:
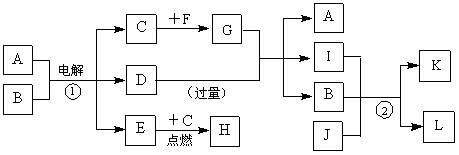
已知:
(a) C、E是气体单质,E是一种理想的清洁能源,F是日常生活中的常用金属;
(b) B、J是氧化物,且J是能使澄清石灰水变浑浊的无色无味气体;
(c) 化合物A、D、I、L的焰色反应显黄色;
(d) 白色沉淀K既溶于H溶液,又能溶于D溶液;
(e) 反应①是工业上生产D和C的重要方法。
请回答下列问题:
(1)写出F的化学式 ,D的电子式 。
(2)写出有关反应的化学方程式:
反应① ;
反应② 。
(3)G溶液呈 性(填“酸”、“碱”或“中”),请用离子方程式表示其原因:
。
13.某同学用镀铜的石墨做阳极、石墨做阴极电解稀硫酸溶液,用曲线Ⅰ表示电解过程中阴极增加的质量(△m)随时间(t)的变化关系,用曲线Ⅱ表示溶液pH随时间(t)的变化关系。下列曲线图合理的是(电解初期溶液中H+放电)
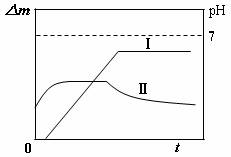
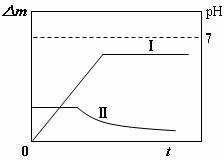
A B
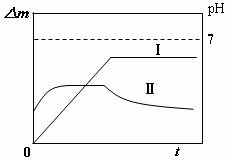
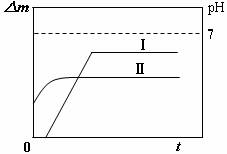
C D
非选择题部分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com