

15.盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1mol C与O2反应生成CO的反应热△H为 ( )
A.-Y kJ/mol B.-(10X-Y) kJ/mol
C.-(5X-0.5Y) kJ/mol D.+(10X-Y) kJ/mol
14.科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料。电池中的一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-。下列对该燃料电池的说法不正确的是 ( )
A.在熔融电解质中,O2-由负极移向正极
B.该电池的总反应是:C3H8+5O2=3CO2+4H2O
C.电路中每通过5mol电子,约有5.6L标准状况下的丙烷被完全氧化
D.通丙烷的电极为电池负极,发生的电极反应为:C3H8-20e-+10O2-=3CO2+4H2O
13.用惰性电极电解硫酸铜溶液一段时间后,向溶液中加入0.15mol Cu(OH)2后恰好恢复到原来浓度,则电路中通过的电子的物质的量为 ( )
A.0.3mol B.0.6mol C.0.15mol D.0.9mol
12.如图所示,锥形瓶中加入亚硫酸钠固体和1:1的硫酸,玻璃管内装入分别滴有不同溶液的棉球,反应一段时间后,对图中指定部位颜色描述正确的是 ( )
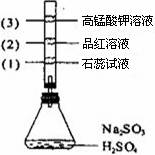
|
|
(1) |
(2) |
(3) |
|
A |
褪色 |
褪色 |
变红 |
|
B |
变红 |
变红 |
褪色 |
|
C |
变红 |
褪色 |
褪色 |
|
D |
褪色 |
变红 |
褪色 |
11.下图中,曲线表示原子序数在前20号中的某些元素的单质的沸点随原子序数变化的关系(原子序数相连且按递增顺序连续排列),其中A点(横轴下的最高点)表示的元素是( )
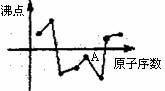
A.Si B.Al C.F D.S
10.如图所示,向一定量的铁粉中加入一定量12mol·L-1的浓硝酸,加热充分反应后,下列微粒在体系中一定大量存在的是 ( )
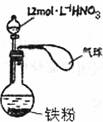
①NO3 ②Fe3+ ③H+ ④NO ⑤NO2
A.只有① B.只有①⑤ C.只有②④⑤ D.①②③⑤
9.下列变化属于放热反应的是 ( )
A.H2O(g)=H2O(1) △H=-44.0kJ/mol
B.2HI(g)=H2(g)+I2(g) △H=+14.9kJ/mol
C.形成化学键时放出能量的化学反应
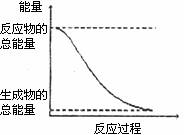
D.能量变化如下图所示的化学反应
8.下列关于氨气的说法正确的是 ( )
A.氨可以用浓硫酸干燥也可用无水CaCl2干燥
B.氨水能导电,所以NH3是 电解质
C.沸点:NH3<PH3
D.用水吸收NH3用下图装置可防止倒吸
7.在甲、乙两烧杯溶液中,含有大量的Cu2+、Na+、H+、SO42-、CO32-、OH-等6种离子。已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是 ( )
A.Cu2+、H+、SO42- B.Na+、OH-、CO32-
C.CO32-、OH-、SO42- D.Na+、H+、SO42-
6.下列反应的离子方程式书写正确的是 ( )
A.硫酸铝溶液中加入过量氨水:Al3++3OH-==Al(OH)3↓
B.在氢氧化钡溶液中逐滴加入硫酸氢钠溶液至恰好呈中性:
Ba2++2OH-+2H++SO42- BaSO4↓+2H2O
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液
Fe2++2H-+H2O2==Fe3++2H2O
D.碳酸钙与醋酸反应:CaCO3+2H+==Ca2++CO2↑+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com