
5.下列事实可以用勒夏特列解释的是: ( )
A.在K2CrO4溶液中加入几滴稀HNO3,颜色加深
B.在KMnO4溶液中加草酸,溶液颜色变浅
C.硫酸工业上500℃高温有利于提高SO3的产量
D.蔗糖制成的方糖沾上少许砻糠灰放在灯焰上灼烧会燃烧
4.最近,由于北方普降大雪,北方煤﹑天然气用量大增,南方煤、气供应出现较大的决口,为此,我们要不断提高化石燃料的热利用率,下列措施不可行的是 ( )
A.使煤液化或汽化 B.用天然气做燃料电池的原料
C.提高化石燃料的脱硫技术 D.降低煤中的杂质灰分与水分的含量
3.一定条件下,钠跟二氧化碳发生如下反应:4Na+3CO2=2Na2CO3+C。由此反应不能说明的是 ( )
A.钠显示了强还原性 B.二氧化碳是酸性氧化物
C.二氧化碳显示了强还原性 D.二氧化碳也能起助燃作用
2.下列说法正确的是 ( )
A.酸性氧化物都能与水化合生成含氧酸
B.碱性氧化物都能与水化合生成碱
C.能电离出H+的化合物一定是酸
D.由阴阳离子组成的化合物一定是离子化合物
1.下列厨房中的变化与氧化还原反应无关的是 ( )
A.料酒久置变酸
B.新切开的土豆片一段时间后变棕黄色
C.食醋滴到大理石板上,大理石变得粗糙
D.新煮的绿豆汤久置变色
24.准确称取6克铝土矿样品(含Al2O3.Fe2O3.SiO2)放入盛有100ml某浓度的硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生的沉淀的质量m与加入NaOH溶液的体积V的关系如图所示。请填空回答:
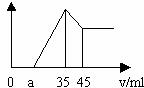
(1)H2SO4溶液的物质的量浓度为多少?
(2)a=2.3,用于沉淀铁离子,消耗氢氧化钠溶液的体积是多少?
23.已知:A、B、E为固体化合物;D、G为固体单质;F、X、Z为可燃性气体,且F、X燃烧的火焰呈蓝色或淡蓝色。在一定条件下它们能实现如图所示的变化。
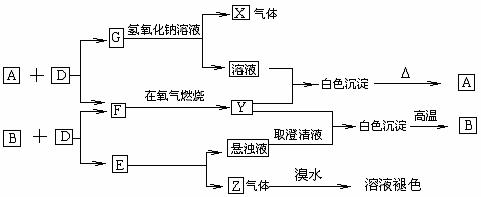
(1)写出A、B、E的名称。A_________,B________,E____________。
(2)写出A 和 D反应的化学方程式______________________。
(2)写出G和氢氧化钠溶液反应的化学方程式_______________________。
(3)写出1molZ跟1molHCl反应的化学方程式________________________。
22.铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[方案一][实验方案]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是 。
[实验步骤]
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2。0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(填“偏高”、“偏低”或“无影响”)。
[方案二] [实验方案]将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01 105Pa)的体积
105Pa)的体积
[问题讨论]
(1)同学们拟选用下列实验装置完成实验:
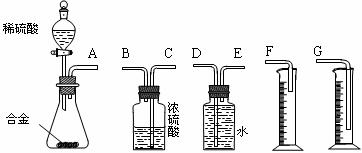
①你认为最简易的装置其连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满。)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因 。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 。
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了下图所示的实验装置。
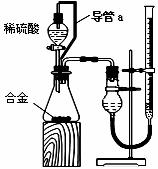
①装置中导管a的作用是
②实验前后碱式滴定管中液面读数分别为V1 mL.V2 mL。则产生氢气的体积为______mL。
21.某无色溶液里,只含有下列八种离子中的某几种:Mg2+、Na+、H+、Ag+、Cl-、HCO3-、OH-、NO3-。已知该溶液能跟金属铝反应, 且放出的气体只有氢气试回答:
(1)若溶液跟Al反应后有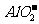 生成, 则原溶液一定含有大量的
离子, 还可能含有大量的
离子。
生成, 则原溶液一定含有大量的
离子, 还可能含有大量的
离子。
(2)若溶液跟Al反应后有Al3+生成, 则原溶液中一定不含有大量 离子
20.物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )
A.1:4 B.1:5 C.2:3 D.2:5
II卷(40分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com