
22.某稀硫酸和硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉的质量增加的变化如下图所示。下列分析或结果正确的是 ( )
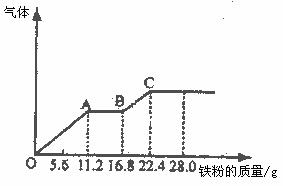
A.混合酸中NO-3物质的理为0.2mol
B.OA段产生的是NO,AB段的反应为:Fe+2Fe3+→3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为5mol·L-1
第二卷(共84分)
21.①pH=3的CH3COOH溶液;②Ph=3的HCl溶液;③Ph=11的氨水;④pH=11的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是 ( )
A.将②、③溶液混合后,pH=7,消耗溶液的体积:②>③
B.水电离产生的c(H+):①=②=③=④
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量;②最大
D.向溶液中加入100mL水后,溶液的pH:③>④>①>②
20.化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是 ( )

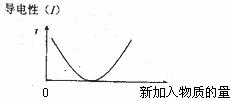
A.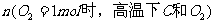 B.乙酸溶液中通入氯气至过量
B.乙酸溶液中通入氯气至过量


C.t秒时合成氨反应达到平衡 D.NaOH溶液滴入Ca(HCO3)2溶液中
19.某反应体系中的物质有NaOH、Au2O3,Na2S4O6,Au2O,H2O,Na2S2O3。Au2O3为反应物,则下列有关说法正确的是 ( )
A.该反应体系中有三种元素的价态发生了变化
B.Au2O在反应中作还原剂
C.Na2S4S6发生还原反应
D.1molAu2O3发生反应,转移电子4mol
18.下列离子方程式正确的是 ( )
A.硫酸铝溶液中加过量氨水:Al3++4OH-→AlO2-+2H2O
B.向苯酚钠溶液中通入少量的二氧化碳:CO2+H2O+C6H5O-→C6H5OH+HCO-3
C.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:
Ba2++2OH-+NH+4+H++SO2-4→BaSO4↓+NH3·H2O+H2O
D.过量铁粉与一定量稀硝酸反应:Fe+4H++NO-3→Fe3++NO↑+2H2O
17.下图表示金属X、Y以及它们的合金Z分别与足量盐酸反应时产生氢气的情况,其中横坐标表示消耗金属的物质的量,纵坐标表示产物氢气的体积(标准状况)。下列对有关Z的组成的判断,正确的是 ( )
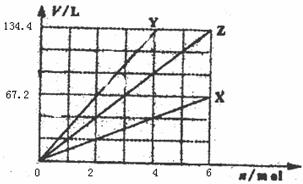
A.n(Na):n(Fe)=2:1 B.n(Mg):n(K)=1:2
C.n(Na):n(Al)=1:3 D.n(K):n(Al)=1:1
16.某溶液中仅含有Na+、H+、OH-、CH3COO-四种离子,下列说法错误的是 ( )
A.若溶液中部分离子间满足:c(CH3COO-)=c(Na+)则该溶液一定呈中性
B.若溶液中溶质仅为CH3COONa,则离子间一定满足:
C(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.溶液中四种离子之间可能满足:c(Na+)>c(OH-)>c(CH3DCOO-)>c(H+)
D.若溶液中的溶质是CH3COONa和CH3COOH,则溶液中离子间一定满足:
C(CH3COO-)>c(Na+)>c(H+)>c(OH-)
15.用NA表示阿伏加德罗数的值。下列叙述正确的是 ( )
A.25°C时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
B.标准状况下,2.24LCl2与过量烯的NaOH溶液反应,转移的电子总数为0.2NA
C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
D.标准状况下,22.4L乙醇中含有的氧原子数为1.0NA
14.已知氯气、溴蒸气分别跟氢气反应的热化学方程如下(Q1、Q2均为正值):
H2(g)+Br2(g)→2HBr(g)+Q1kJ;H2(g)+I2(g) 2HI(g)-Q2kJ
2HI(g)-Q2kJ
有关上述反应的叙述正确的是 ( )
A.1L氢气和1L碘蒸气生成2L碘化氢气吸收Q2热量
B.生成物总能量均高于反应物总能量
C.生成1molHBr气体时放出Q1热量
D.1molHI(g)具有的能量大于1molHI(1)具有的能量
13.下列说法正确的是 ( )
A.金属腐蚀就是金属原子失去电子被还原的过程
B.钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e→4HO-
C.氯碱工业中,阳极发生的反应为:2Cl-–2e→Cl2↑
D.镀锌铁皮的镀层损坏后,铁更容易腐蚀
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com