
21.(8分)柠檬酸(C6H8O7)是一种天然有机酸,广泛存在于植物中,如柠檬、葡萄汁中。柠檬酸具有如下性质:
①不能发生银镜反应;
②在浓硫酸催化下,与乙酸可发生酯化反应;
③1mol柠檬酸与足量的碳酸氢钠溶液反应可放出3molCO2;
④核磁共振氢谱表明柠檬酸中有4种不同类型的氢原子,其中4个氢处于完全相同的化学环境。
请回答:
(1)柠檬酸中氧元素的质量分数为_________(保留0.1%);
(2)根据以上信息,对柠檬酸的结构可作出的判断是___________;
a.肯定有碳碳双键 b.肯定有羟基
c.有3个羧基 d.有一个苯环
(3)在浓硫酸催化和适宜条件下,柠檬酸与足量的乙醇反应生成A(C12H20O7),A中只有两种官能团,其数目比为3:1。柠檬酸与乙醇反应生成A的化学方程式是:___________;
(4)柠檬酸发生消去反应失去1分子水后形成化合物B,B的结构简式是:_______________.
20.(8分)“嫦娥一号”登月成功,实现了中国人“奔月”的梦想。“嫦娥一号”使用的推进剂是液氢和液氧,这是我国科学家对化学反应热的成功应用。
(1)下列说法或表示方法正确的是_________(填序号)。

a.需要加热才能发生的反应一定是吸热反应
b.在稀溶液中,H+(aq)+OH-(aq)==H2O(1)△H=-57.3 kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
c.由C(石墨)==C(金刚石)△H=73 kJ·mol-1,可知金刚石比石墨稳定
d.能量变化如图所示的化学反应为放热反应
(2)已知:O2(g)==O2+(g)+e- △H1=1175.7 kJ·mol-1
PtF6(g)+e- ==PtF6-(g) △H2=-771.1 kJ·mol-1。
O2+PtF6-(s)==O2+(g)+PtF6-(g) △H3=482.2 kJ·mol-1
则O2与PtF6反应生成O2+PtF6-的热化学方程式为____________。
(3)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与形成新化学键的键能之和的差。下表是一些化学键的键能。
|
化学键 |
C-H |
C-F |
H-F |
F-F |
|
键能/kJ·mol-1 |
414 |
489 |
565 |
155 |
根据键能数据估算:CH4(g)+4F2(g)==CF4(g)+4HF(g)的反应热△H为______________
19.(10分)芬必得是一种高效消炎药,其主要成分布洛芬有多种合成路线。下图所示就是一种合成方法:

已知:R-Cl+NaCN→R-CN+NaCl
R-CN R-COOH
R-COOH
回答下列问题:
(1)写出有机物B、E的结构简式:
B__________,E__________。
(2)指出下列反应类型:A→B:__________,B→C:__________。
(3)关于有机物C的下列说法中,正确的是_________(填序号)。
a.与苯酚互为同系物 b.能与NaOH溶液反应
c.能发生消去反应 d.能发生加成反应
(4)A的同分异构体有多种,写出同时符合下列条件的A的结构简式:_________。
①苯环上有两个取代基
②苯环上的一氯代产物只有一种
18.(10分)今有下列有机物:A.乙醇 B.苯酚C.CH2=CH-CH3,D.葡萄糖 E.淀粉 F.蔗糖 G.HCOOCH2CH3,试用字母代号填空:
(1)能用来杀菌消毒的是____________________;
(2)能与NaOH溶液反应的是____________________;
(3)因发生加成反应使溴水退色的是____________________;
(4)能发生银镜反应的是____________________;
(5)在工业上,一定条件下能用来合成高分子化合物的是____________________;
(6)水解最终只生成一种有机物的是____________________。
17.(12分)通过学习,你已经对化学能与电能之间的能量转化问题有了进一步的认识。请根据所学知识,完成下列空格:
Ⅰ.某化学兴趣小组为了探究铝在原电池中的作用,设计并进行了一系列实验,实验结果记录如下:
|
编号 |
电极材料 |
电解质溶液 |
电流计指针偏转方向 |
|
① |
Mg,Al |
稀盐酸 |
偏向Al |
|
② |
Al,Cu |
稀盐酸 |
偏向Cu |
|
③ |
Al,石墨 |
稀盐酸 |
偏向石墨 |
|
④ |
Mg,Al |
氢氧化钠溶液 |
偏向Mg |
|
⑤ |
Al,Zn |
浓硝酸 |
偏向Al |
(1)请写出编号②中的电极反应式:
正极反应:__________;负极反应:__________
(2)编号④中作负极的材料是__________。
(3)根据上表中的实验现象推知:在原电池中,金属铝作正极还是负极受__________、__________、电解质溶液的氧化性等因素的影响。
Ⅱ.下图表示一个电解池,管中装有饱和食盐水,X、Y都是惰性电极。实验开始时,同时在两边滴入几滴酚酞溶液。请回答:

(1)电解过程中,在X极附近观察到的实验现象是__________;检验Y极反应产物的方法是__________。
(2)若收集到的H2为1L,则同样条件下收集到的Cl2__________(填“>”、“=”或“<”)1L,原因是______________________________(用离子方程式表示)。
16.25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀。有关物质的颜色和溶度积如下:
|
物质 |
AgCl |
AgI |
Ag2S |
|
颜色 |
白 |
黄 |
黑 |
|
Ksp(25℃) |
1.8×10-10 |
1.5×10-16 |
1.8×10-50 |
下列叙述不正确的是
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.无法实现由AgI向AgCl转化
C.25℃时,饱和AgCl、Agl、Ag2S溶液中,Ag2S溶液中Ag+的浓度最小
D.25℃时,在饱和Agl溶液中加入AgNO3固体,I-浓度减小
第Ⅱ卷
15.电镀等工业废水中常含有剧毒、致癌的Cr2O72-。处理该废水的一种方法是:向废水中加入适当的NaCl,用Fe作电极进行电解,经过反应后Cr2O72-被除去。下列说法错误的是
A.电解时,阳极反应为:Fe→Fe2++2e-
B.电解过程中阴极能产生氢气
C.用氢氧燃料电池作为电解电源,每转移1mol电子消耗1g氢气
D.电解过程中Na+向阳极移动
14.50mL 0.1 mol·L-1的NaOH溶液被0.1 mol·L-1CH3COOH溶液中和,曲线如图所示,有关粒子浓度关系不正确的是

A.在B到D任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B.在B点c(Na+)=c(CH3COO-);c(OH-)=c(H+)
C.滴定过程中 为定值(不考虑温度变化)
为定值(不考虑温度变化)
D.滴定过程中可能出现c(Na+)>c(CH3COO-);c(H+)>(OH-)
13.把7molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:
3A(g)+B(g)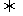 2C(g)+xD(g)经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol·L-1·min-1,下列说法中错误的是
2C(g)+xD(g)经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol·L-1·min-1,下列说法中错误的是
A.x=2
B.平衡后再向其中加入7molA气体和5molB气体达到新平衡后C的百分含量增大
C.平衡时B的浓度为l mol·L-1
D.在该温度下反应的平衡常数为0.0625
12.下列各组离子能大量共存的是
A.Mg2+、Na+、SO42-、Cl- B.Fe3+、CO32-、Cl-、NO3-
C.Na+、H+、NO3-、Fe2+ D.NH4+、Na+、HCO3-、OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com