

27.(15分)
已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:
(注意:其中有些反应的条件及部分生成物被略去)
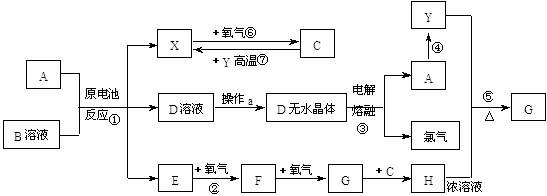
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为: 。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为______________________________________________。
(5)原电池反应①中正极的电极反应式为 。
13.将一定质量的镁、铜组成的混合物加入稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO)。向反应后的溶液中加入3mol/NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列叙述中正确的是 ( )
A.当生成沉淀达到最大量时,消耗NaOH溶液的体积为100mL
B.当金属全部溶解时收集到NO气体的体积为2.24L
C.参加反应的金属的总质量一定是6.6g
D.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
第Ⅱ卷
12.对于平衡体系mA(g)+nB(g) pC(g)+qD(g);△H<0。下列结论中不正确的是 ( )
pC(g)+qD(g);△H<0。下列结论中不正确的是 ( )
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
D.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
11.下列离子方程式正确的是 ( )
A.氢氧化钙溶液与碳酸氢镁溶液反应:HCO-3+Ca2++OH-=CaCO3↓+H2O
B.将标准状况下112mL氯气通入10mL 1 mol·L-1的溴化亚铁溶液中:
2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2
C.向Na2S2O3溶液中通入足量氯气:S2O2-3+2Cl2+3H2O=2SO2-3+4Cl-+6H+
D.酸性FeSO4溶液中加入双氧水:2Fe2++H2O2+2H+=2Fe3++2H2O
10.某晶体由两种阳离子、一种阴离子和结晶水组成,取少量该晶体进行如下实验:
①将晶体置于试管中加热,试管口有液体生成
②待试管冷却后,加水使固体全部溶解
③向试管中逐滴加入Ba(OH)2溶液至过量,同时加热,沉淀的物质的量先增多后减少,但最终仍有沉淀未溶解,在此过程中还有刺激性气味气体生成。根据以上实验判断,该晶体是 ( )
A.NH4Al(SO4)2·12H2O B.KAl(SO4)2·12H2O
C.(NH4)2Fe(SO4)2·6H2O D.KCl·MgCl2·6H2O
9.某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是 ( )
A.它是副族元素 B.它是第六周期元素
C.它的原子核内有63个质子 D.它的一种同位素的核内有89个中子
8.设NA为阿伏加德罗常数的值,下列有关叙述正确的是 ( )
A.28g乙烯和28g丙烯中均含有6NA对共用电子对
B.在熔融状态下,1molNaHSO4完全电离出的阳离子数目为2NA
C.7.8g Na2O2含有的阴离子数目为0.2NA
D.在含4mol Si-O键的石英晶体中,氧原子的数目为4NA
7.氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
A.再通入少量氯气,c(H+)/c(ClO-)减小
B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量水,水的电离平衡向正反应方向移动
6.下列化学用语表示正确的是 ( )
A.CO2的比例模型:
B.NCl3的电子式为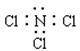
C.氢硫酸的电离H2S+H2O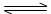 H3O++HS-
H3O++HS-
D.CrO5的结构式为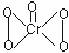 ,该氧化物中Cr为+5价
,该氧化物中Cr为+5价
22.(12分)平衡常数是化学反应的特性常数。回答下列的问题:
(1)工业制硫酸的核心反应是:2SO2(g)+O2(g)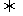 2SO3(g) △H<0。
2SO3(g) △H<0。
将一定量的SO2(g)和O2(g)放入1L密闭容器中,在一定条件下达到平衡,测得SO2为0.11 mol,O2为0.05 mol,SO3为0.12 mol。计算该条件下,反应的平衡常数K=_______(保留l位小数)。随着温度的升高,上述平衡常数将__________(填“增大”、“减小”或“不变”)。
(2)某探究小组在某温度下测定溶液的pH时发现,0.01mol·L-1的NaOH溶液中,由水电离出的c(H+)·c(OH-)=10-22(mol·L-1)2,则此时Kw=________。该小组在该温度下测得0.1mol·L-1的NaOH溶液pH应为__________。
(3)对于某一元弱酸HA,当用蒸馏水稀释时,若不考虑温度变化,则Ka______________(填“变大”、“变小”或“不变”)。常温下,将0.1molNaA和0.05molHCl溶于1L水中(忽略体积变化),得到pH<7的溶液,则溶液中离子浓度由大到小的顺序是:_______________;溶液中c(A-)+c(OH-)-c(H+)=_________mol·L-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com