

7.下列条件下,两瓶气体所含的原子数一定相等的是 ( )
①同质量不同密度的CO和N2 ②同温同体积的H2和Cl2
③同体积同密度的C2H4和C2H6 ④同压同体积的N2O和CO2
A.①③ B.①② C.②④ D.③④
6.钾的冶炼可采用如下方法:2KF+CaC2 CaF2+2K↑+2C下列有关说法合理的是( )
CaF2+2K↑+2C下列有关说法合理的是( )
A.当转移1mol电子时,生成39g钾
B.该反应说明碳的还原性比钾强
C.该反应的还原剂是碳化钙,氧化产物是钾
D.碳化钙和氧化钙都是真子化合物,且阴、阳离子个数比均为2:1
5.NA表示阿伏加德罗常数,则下列说法正确的是 ( )
A.含有0.5molNa2CO3的溶液中溶质的离子总数不是1.5NA
B.1mol碳原子数为n的烷烃分子中含有的共价键总数为3nNA
C.Na2O2与水反应生成2.24L O2转移的电子数为0.2NA
D.7.8g过氧化钠所含的阴离子数为0.2NA
4.焰火“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列有关焰色反应的说法正确的是 ( )
A.每次实验后,要用盐酸或硫酸把铂丝洗净
B.没有铂丝,也可用光洁无锈的铁丝或铜丝代替
C.焰色反应均应透过蓝色钴玻璃观察
D.NaCl与Na2CO3灼烧时火焰颜色相同
3.下列物质熔化或溶解于水均不破坏化学键的是 ( )
A.氯化铵 B.丙醇 C.硫酸 D.干冰
2.下列叙述正确的是 ( )
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.元素由化合态变成游离态时,它可能被氧化,也可能被还原
C.失电子难的原子,获得电子的能力一定强
D.有单质参加或生成的反应一定属于氧化还原反应
1.溶液、胶体和悬浊液这三种分散系的本质区别是 ( )
A.是否为大量分子或离子的集合法 B.能否透过滤纸或半透膜
C.分散质粒子的大小 D.能否产生丁达尔现象
30.(15分)
(1)配平氧化还原反应方程式:□C2O2-4+□MnO-4+□H+=□CO2+□Mn2++□H2O
(2)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL 溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。
①第一份溶液中加入2滴酚酞试液,滴加0.25 mol/L NaOH 溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H 的物质的量为 mol。
②第二份溶液滴加0.10 mol/L 酸性KMnO溶液至16mL时反应完全,此时溶液颜色由 变为_________。
③原试样中H2C2O4•2H2O的质量分数为 。(要求写出计算过程,5分)
29.(12分)
t℃时,将3 molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(气)+B(气) xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
(1)x=__________。
(2)比较达到平衡时,A、B两反应物的转化率:α(A)________α(B)(填>、=或<)
(3)若继续向原平衡混合物的容器中通人少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是____________(填写字母序号)
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率保持不变
(4)在t℃时,若向原平衡混合物的容器中再充人amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充人_______(填A或B)_______mol(用a表示)。
28.(18分)
X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成。X有5个原子核。通常状况下,W为无色液体,已知:X+Y Z+W,回答下列问题:
Z+W,回答下列问题:
(1)Y的电子式是 。
(2)液态Z与W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是 。
(3)用图示装置制备NO并验证其还原性。有下列主要操作:
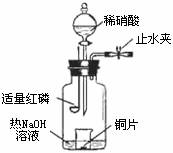
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作是 。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是 。
③步骤c滴入稀硝酸后烧杯中的现象是 。
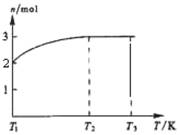
(4)一定温度下,将1mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。则温度在T2~T3之间,气体的平均相对分子质量是 (保留1位小数)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com