
10.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是

A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6 + 6H2O – 24e- == 6CO2 + 24H+
C.放电过程中,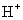 从正极区向负极区迁移
从正极区向负极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下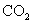 气体
气体
9.下列离子方程式书写正确的是
A.硫酸亚铁溶液中加入酸化的双氧水:Fe2++2H++H2O2 = Fe3++2H2O
B.0.1molFeBr2溶液中通入0.1molCl2:2Fe2+ + 4Br-+ 3Cl2 = 2Fe3+ + 2Br2 + 6Cl-
C.向饱和碳酸氢钙溶液中加入足量氢氧化钠溶液:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
D.用铂电极电解氯化镁溶液:2Cl- + 2H2O = Cl2↑+H2↑+2OH-
8.常温下,0.1mol/L某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8 ,下列叙述正确的是
A.向该溶液中加入一定量NaA晶体,溶液中c(OH-)增大
B.该溶液中c(H+)+c(A-)+c(HA)=0.1mol/L
C.该溶液与0.05mol/L NaOH溶液等体积混合后:
c(A-)>c(Na+)>c(OH-)>c(H+)
D.该溶液中水电离出的c(H+)=1×10-10mol/L
7.下列有关化学用语使用正确的是
A.硫原子的原子结构示意图: B.NH4Cl的电子式:
B.NH4Cl的电子式: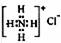
C.原子核内有10个中子的氧原子: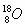 D.硝基苯的结构简式:
D.硝基苯的结构简式: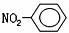
6.有关下列说法:①美国总统奥巴马出访中国时,与我国高层共同发表了联合声明,其中提出的低碳经济理念,是指不再使用含碳物质或者减少含碳物质的使用,从而改变世界环境;②汽油、柴油和植物油都是碳氢化合物;③只有一种元素组成的物质,一定是纯净物;④化学反应的实质就是旧化学键的断裂、新化学键形成的过程:⑤硝酸和氢硫酸两者既具有氧化性又具有还原性;⑥含有共价键的晶体一定是原子晶体;⑦等物质的量的13C17O和15N2两种气体具有相同的质子数、原子数和质量。其中正确的是
A.①④⑤ B.③④⑥ C.④⑤⑦ D.①④⑦
13.(13分)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:
2SO2(g)+O2(g)  2SO3(g) △H=-196.6kJ/mol,2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,回答下列问题:
2SO3(g) △H=-196.6kJ/mol,2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,回答下列问题:
(1)从反应开始至达到化学平衡,生成SO3的平均反应速率为_____________,平衡时SO2的转化率为____________。
(2)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)__________。
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内原子总数不再发生变化 D.混合气体的密度不再发生变化、
E.V正(SO2)=2V逆(O2) F.SO3的生成速率是O2消耗速率的2倍
(3)反应达化学平衡后,以下操作将引起平衡向正反应方向移动,并能提高SO2转化率的是______________。
A.向容器中通入少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氩气(已知氩气和SO2、O2、SO3都不发生反应)
(4)如开始加入2.2 mol SO2和y mol O2,平衡时生成0.6mol SO3,则y = _______。
12.(15分)某课外活动小组设计了以下实验方案验证Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
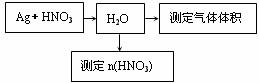
(1)测定硝酸的物质的量
反应结束后,从下图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,消耗NaOH溶液的体积为20.00mL。在B容器中生成硝酸的物质的量为 ____ mol,则Ag与浓硝酸反应过程中生成的NO2体积为 mL。
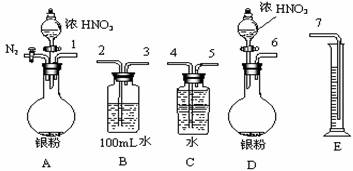
(2)测定NO的体积
①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验,选用的理由是 。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置
(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
若实验测得NO的体积为112.0mL(已折算到标准状况),则Ag与浓硝酸反应的过程中 (填“有”或“没有”)NO产生,作此判断的依据是 。
11.(13分)已知中学常见物质的转化关系如图,A、F为日常生活常见金属单质,C、D为非金属单质,D为黄绿色气体,其余为化合物,G常温下为无色无味液体,回答下列问题:
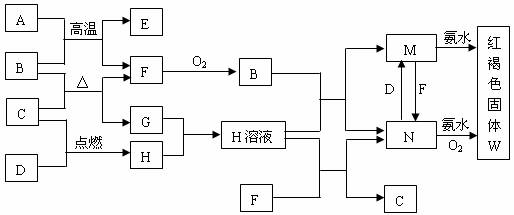
(1)C、D、M的化学式分别为___________、___________、_____________。
(2)写出A和B高温条件下反应的化学方程式_______________________________。
(3)写出下列反应的离子方程式:
M→N:_______________________________________
N→W:________________________________________
(4)A和B的反应属于置换反应,A与其它一些金属氧化物也能发生类似的反应,这类反应在化学上被称为___________反应,写出这类反应的两种用途__________________。
10.(14分)短周期主族元素A、B、C、D、E、F六种元素,原子序数依次增大,A和C同主族,B和E同主族,B和E的原子序数和为A和C原子序数和的2倍,D是地壳中含量最多的金属元素,回答下列问题:(以下各问题均用具体的离子符号或化学式表示)
(1)C、D、E、F形成的简单离子半径由大到小顺序为_____________________。
(2)B、E气态氢化物的稳定性_________>____________。
(3)B、C形成的化合物C2B2所含化学键类型:______________________________。
(4)CA和EF2的电子式分别为___________________,__________________。
(5)F元素在周期表中的位置:________________________________。
(6)E、F最高价含氧酸的酸性:_______________>___________________。
(7)E、F形成简单离子的还原性:____________>____________。
9.一定量Na2O2和NaHCO3固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留固体物质下表中不正确的是:
|
|
Na2O2/mol |
NaHCO3/mol |
残留的固体物质 |
|
A |
1 |
2 |
Na2CO3 |
|
B |
1.5 |
2 |
Na2O2 Na2CO3 |
|
C |
2 |
1 |
Na2O2 NaOH NaHCO3 |
|
D |
2 |
2 |
NaOH Na2CO3 |
第II卷 非选择题(共55分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com