
2.衡量空气质量好坏的指标是( )
A.NO x B.CO x C.API D.SO x
1.某日某市市区各项污染物污染指数分别为:SO2-49,NO2-21,PM10-23,则当日的首要污染物为( )
A.SO2 B.NO2 C.PM10 D.都不正确
25.(15分)在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,发生H2 (g)+I2 (g)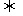 2HI(g)的反应,达到平衡后,测得c(H2)=0.0080mol·L-1。
2HI(g)的反应,达到平衡后,测得c(H2)=0.0080mol·L-1。
(1)求该反应的平衡常数;
(2)在上述温度下,该容器中若通入H2和I2蒸气各0.20 mol,试求达到化学平衡状态时各物质的浓度及H2的转化率。
24.(6分)在一定温度下,把2molSO2和1molO2通入一个一定容积的密闭容器里发生如下反应:2SO2(g)+O2(g) 2SO3(g),当此反应进行到一定程度时反应混合物就处于化学平衡状态。现在该容器维持温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量(mol),如果a、b、C取不同的数值,它们必须满足一定的相互关系才能保证达到平衡时,反应混合物中三种气体的质量分数仍跟上述平衡时的完全相同。请填写下列空白:
2SO3(g),当此反应进行到一定程度时反应混合物就处于化学平衡状态。现在该容器维持温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量(mol),如果a、b、C取不同的数值,它们必须满足一定的相互关系才能保证达到平衡时,反应混合物中三种气体的质量分数仍跟上述平衡时的完全相同。请填写下列空白:
(1)若a=0,b=0,则c=_________________。
(2)若a=0.5,则b=________________和c=________________。
23.(15分)以H2、O2为原料,用石墨作电极,KOH作电解质溶液组成燃料电池,则此燃料电池的负极发生_________________反应;电极反应式为_________________;正极发生_________________反应;电极反应式为_________________,一段时间后,溶液的碱性_________________(填“增大”“减小”“不变”)
22.(2分)已知298K时,C(s)+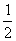 O2==CO(g) △H1=-110.5KJ/mol
O2==CO(g) △H1=-110.5KJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5 KJ/mol
则此温度下:CO(g)+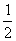 O2(g)=CO2(g)的△H为_________________.
O2(g)=CO2(g)的△H为_________________.
21.(2分)写出298K时,3molNO2(g)与1molH2O(l)反应生成HNO3(aq)和NO(g),放热138kJ的热化学方程式_________________。
20.用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L(标准状况)氧气,从而可知M的相对原子质量是( )
A.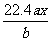 B.
B.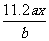 C.
C. D.
D.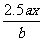
第Ⅱ卷(非选择题共40分)
19.对于2NO2 N2O4(放热),增大压强(缩小体积),下列说法正确的是( )
N2O4(放热),增大压强(缩小体积),下列说法正确的是( )
A.平衡逆向移动, B.混合气体颜色先变深后变浅
C.混合气体颜色先变浅后变深 D.混合气体的平均相对分子质量变小
18.对于密闭容器中进行的反应:CaCO3(s) CaO(s)+CO2(g);△H>0,达平衡后,升高温度,对反应速率的叙述正确的是( )
CaO(s)+CO2(g);△H>0,达平衡后,升高温度,对反应速率的叙述正确的是( )
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.正逆反应速率都增大,平衡向正反应方向移动
D.正逆反应速率都减小,平衡向正反应方向移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com