
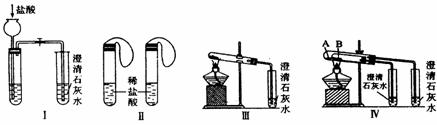
(1)若用实验Ⅳ来验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好
是 ,实现现象是 。
(2)若用实验来鉴别碳酸钠和碳酸氢钠两种固体,能达到实验目的的是(填装置序号) 。其中能够说明泡沫灭火器中选择碳酸氢钠与酸反应制CO2而不选择碳酸钠的实验是 。
(3)若测定Na2CO3固体中混有的少量NaHCO3的质量分数,Ⅲ能否达到实验目的?若能,请说明其计算所需的数据 ;若不能,请简要说明理由 。实验二、将碳酸钠与碳酸氢钠溶液分别与澄清石灰水混合并充分反应。
(1)当石灰水过量时,反应的离子方程式分别为 、
。
(2)当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为 ,请设计实验检验所得溶液中溶质的阴离子 。
30.(8分)将3.20g Cu溶于B mol/L过量的硝酸溶液30.0 mL中,假设硝酸的还原产物只有NO2和NO,反应结束后,将所剩溶液加水稀释至1000 mL,测得c(NO3-)=0.200 mol/L。
(1)稀释后溶液的c(H+)= 。
(2)生成的NO2和NO的物质的量分别为(用含有B的代数式表示) 、 。
(3)用NaOH溶液吸收氮的氧化物是防止NOx污染的一种方法。原理为:
2NO2+2NaOH=NaNO3+NaNO2+H2O,NO+NO2+2NaOH=2NaNO2+H2O
若生成的混合气体能被NaOH溶液完全吸收,则讨论B的取值范围是 。
29.(16分)
|
28.(20分)为防止碘缺乏病,通常在食盐中加入KIO3。
(1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程式是 ,
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液将I2还原,又可以回收四氯化碳。Na2SO3稀溶液与I2反应的离子方程式是 。反应后分离出四氯化碳的操作叫 。
(3)已知:I2+2S2O32-=2I-+S4O62-。某课外活动小组为测定混有MgCl2的食用加碘盐中所含MgCl2、KIO3的含量,按下图所示实验步骤进行实验。
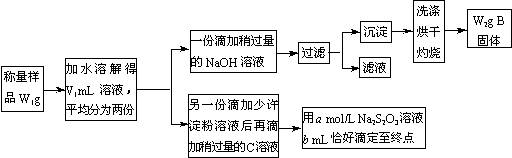
请回答下列问题:
①将W1g样品配成V1 mL溶液所需的玻璃仪器有 、 、烧杯和玻璃棒;灼烧沉淀所需的硅酸盐仪器有 、 、 和玻璃棒。
②B的化学式是 。
③用a mol·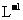 Na2S2O3溶液进行滴定时,洗净的碱式滴定管应先
,再盛装该Na2S2O3溶液标准液。判断滴定达到终点的现象是
。
Na2S2O3溶液进行滴定时,洗净的碱式滴定管应先
,再盛装该Na2S2O3溶液标准液。判断滴定达到终点的现象是
。
④KIO3的质量分数是 (列出计算式)。
⑤洗涤沉淀的方法是 。
⑥下列操作,可能导致所测MgCl2的质量分数偏高的是(填写字母) ;
A.过滤后未洗涤所得沉淀,直接烘干灼烧
B.沉淀灼烧不彻底
C.在敞口容器中用托盘天平称量样品时,操作时间过长
D.用托盘天平称量沉淀时,砝码放在左盘,称量物砝码放在右盘
27.(12分)某无色透明溶液可能含有下列离子:K+、Fe3+、Cu2+、Ba2+、[Al(OH)4]━、NO3━、CO32-、SO32-、SO42-、Br-、I-、Cl-。取该溶液按如下步骤进行实验。
(1)请你根据下表Ⅰ栏中的实验结果,回答Ⅱ栏中有关问题:
|
Ⅰ实验结果 |
Ⅱ回答问题 |
|
①取溶液少许,滴加足量氯水,产生沉淀;过滤,滤液加CCl4,振荡后,CCl4层未变色。 |
①该步实验说明溶液中不存在 离子。 |
|
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色。 |
②该步实验发生反应的离子方程式为 。 |
|
③取溶液少许,加盐酸酸化后,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失。 |
③产生白色沉淀的离子方程式为 。 |
|
④取溶液少许,滴加2滴酸性高锰酸钾溶液,紫色立即褪去。 |
④该步实验说明溶液中存在
离子。 |
|
⑤取溶液少许,加足量Ba(NO3)2溶液产生白色沉淀,过滤;往洗涤后的沉淀中加入足量盐酸,沉淀部分溶解,有无色气体产生。 |
⑤未溶解的白色沉淀是
;将气体通入品红溶液的现象是
。 |
|
⑥取步骤⑤所得滤液,加HNO3酸化后,再加AgNO3溶液,溶液中析出白色沉淀。 |
⑥该步骤是否有意义
(填“有”或“无”)。 |
(2)综上,该溶液的pH (填“>”、“<”或“=”)7;该溶液中一定存在的阳离子是 ,不能确定是否存在的离子是 ;现欲取原溶液检验其是否存在,是否要使用试剂,若不要使用试剂,其实验方法是 ;若要使用试剂,选用的试剂是(按使用的先后顺序依次写出) 。
26.(8分)原子序数从小到大排列的四种短周期元素W、X、Y、Z,四种元素的原子最外层电子数之和等于12;W是原子半径最小的元素;由X、Y元素可组成共价化合物A,A常用作灭火剂和制冷剂;由Y、Z元素按原子个数比1:1可组成离子化合物B;A与B反应可生成Y2气体。
(1)元素W在元素周期表中的位置是 。
(2)A与B反应的化学方程式为 ;该反应的用途为(写一种) 。
(3)写出金属镁在A中燃烧的化学方程式: 。
(4)C是由X、Y、Z三种元素组成的盐,C能与盐酸反应生成A,则C的化学式是 。
(5)由W、Y、Z三种元素按原子个数比为1:1:1组成的一种一种常见化合物D,是重要的工业产品,写出工业制取该化合物的化学方程式 。
25.(6分)(1)部分短周期元素的原子半径及常见化合价如下表:
|
元素代号 |
M |
Q |
R |
T |
X |
|
原子半径/nm |
0.160 |
0.143 |
0.099 |
0.074 |
0.102 |
|
常见化合价 |
+2 |
+3 |
-1 |
-2 |
+6,-2 |
(1)R元素的阴离子结构示意图为 。
(2)探究M和Q两种元素金属性强弱的实验方法是
(用元素符号表示M和Q)。
(3)工业生产中排放的SO2用饱和Na2XO3溶液吸收可化害为利生产化工原料,该反应的化学方程式为 。Na2XO3常因为T单质的存在而变质,常用 和 两种试剂检验其是否变质。
24.(8分)一个完整的氧化还原反应方程式可以拆成两个“半反应式”:一个是“氧化反应式”,一个是“还原反应式”。如:2Fe3+ +Cu→2Fe2+ + Cu2+的拆写结果是:
氧化反应式是:Cu-2e-→Cu2+;还原反应式是:2Fe3+ + 2e-→2Fe2+
(1)有NH4+、NO3-、Fe3+、Fe2+、H+和H2O六种粒子分别属于同一氧化还原反应中的反应物和生成物。写出并配平该反应的化学方程式 。
①上述反应中氧化剂和还原剂的物质的量之比为 ,每消耗1mol 氧化剂转移电子______个。
②请将上述反应拆写成两个半反应式:(用离子表示)
氧化反应式是: ;还原反应式是: 。
(2)已知某个反应的半反应式:
氧化反应式是:CH4 + 10OH--8e-→CO32- + 7H2O
还原反应式是:O2 + 2H2O + 4e-→4OH-
则总反应的离子方程式为__________________________________________。
23.(8分)中学化学常见的物质A、B、C、D之间存在如下图所示的转化关系。请按要求填空:

(1)若A是水垢和蛋壳的主要成分之一,B是厨房常见某调味品的一种成分,C常用于制作饮料,请写出该反应的离子方程式: 。
(2)若A为黑色固体单质,C、D均能使石灰水变浑浊,则该反应的化学方程式为 。
(3)若A为红色金属单质,该反应在常温下可以发生,无色气体C遇空气迅速变成红棕色,则产生1molC被氧化的A的物质的量为 。
(4)若A为黑色粉末,C能使品红溶液和石蕊试液褪色,则反应中还原剂与氧化剂的物质的量之比为 。
(5)若A为白色乳状物,其水溶液是实验室常用的检验试剂,D可作干燥剂,请写出C水解的离子方程式 和工业上制取B的阳极反应式 。
(6)若A为无色晶体,易分解,分解产物之一遇C产生大量白烟,则检验A中阳离子的方法是 。
22.向含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是 ( )
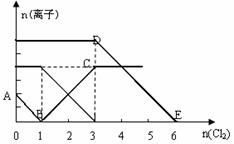
A.线段BC代表Fe3+物质的量的变化情况
B.原混合溶液中c(FeBr2)=6mol/L
C.当通入Cl2 2mol时,溶液中已发生的离子反应可表示为:
2Fe2++2I━+2Cl2=2Fe3++I2+4Cl━
D.原溶液中n(Fe2+):n(I━):n(Br━)=2:1:3
第Ⅱ卷(非选择题 共84分)
21.在t℃时,将agNH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρg·cm-3,质量分数为ω,其中含NH4+的物质的量为b moL。下列叙述中不正确的是 ( )
A.溶质的质量分数为ω=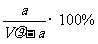
B.溶质的物质的量浓度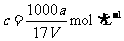
C.溶液中c(OH-)=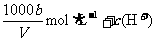
D.上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5ω
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com